2023年6月5日,恒瑞医药宣布,于正在进行的2023年美国临床肿瘤学会(ASCO)年会上,复旦大学附属肿瘤医院田文娟教授以口头报告的形式公布了卡瑞利珠单抗联合阿帕替尼(“双艾”组合)治疗既往至少接受过一种全身治疗失败的晚期或复发性子宫内膜癌患者的2期CAP 04研究最新结果。
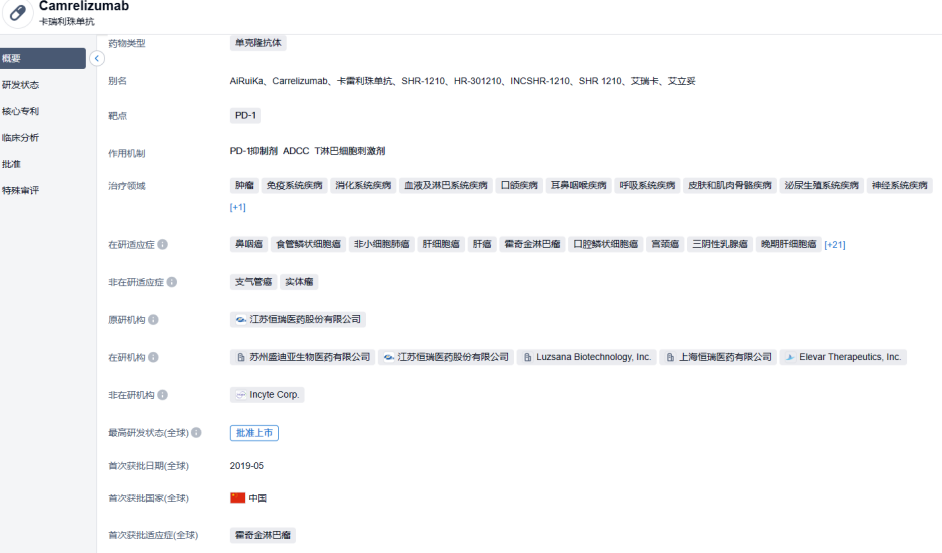
卡瑞利珠单抗为一款人源化抗PD-1单克隆抗体,已获批9个适应症,涉及经典型霍奇金淋巴瘤、肝细胞癌、鳞状/非鳞状非小细胞肺癌、食管鳞癌、鼻咽癌等不同肿瘤。阿帕替尼是一款口服VEGFR2抑制剂,已在中国获批治疗晚期胃腺癌或胃食管结合部腺癌和肝细胞癌。今年1月,“双艾”组合在中国获批晚期肝细胞癌一线治疗适应症,该联合疗法目前已在美国进入递交新药上市申请准备阶段。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
此次研究为开放标签、单臂、2期临床试验,研究采用Simon’s两阶段设计。既往至少接受1次全身治疗后进展的晚期或复发性子宫内膜癌患者采用卡瑞利珠单抗(200 mg,静脉注射,每2周1次)和阿帕替尼(250mg,口服,每天1次)治疗,每4周为1周期,直至疾病进展或出现无法耐受的不良反应。主要终点为RECIST V1.1评估的客观缓解率。其他研究终点包括疾病控制率、至缓解时间、缓解持续时间、至治疗失败时间、无进展生存期、总生存期和治疗相关不良事件。研究结果显示,自2020年1月20日至2022年10月14日,研究共纳入36例患者,中位年龄60岁,其中ECOG评分1分者17例(47.2%),既往至少接受两次全身治疗者15例(41.7%)。截至数据截止日期(2022年12月31日),中位随访时间为13.9个月。36例患者均可评估疗效,经确认的客观缓解率为44.4%,经确认的疾病控制率为88.9%,其中完全缓解2例,部分缓解14例,病情稳定16例。中位无进展生存期为6.4个月。研究结论显示,卡瑞利珠单抗联合阿帕替尼在既往全身治疗失败的晚期或复发子宫内膜癌患者中显示出良好的抗肿瘤活性和可控的毒性,值得进一步研究。
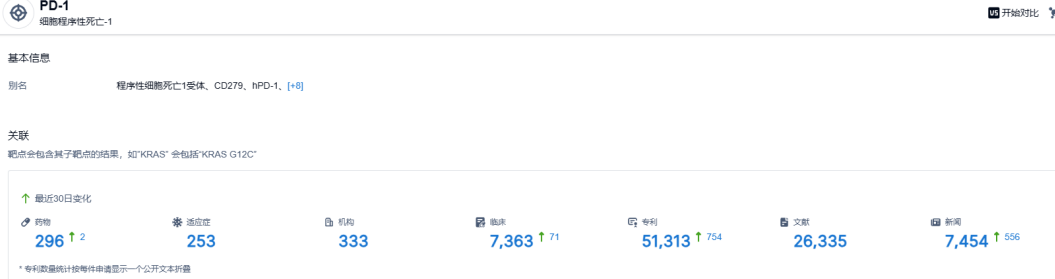
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 PD-1 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年6月6日,PD-1 靶点共有在研药物296个,包含的适应症有253种,在研机构333家,涉及相关的临床试验7363件,专利多达51313件。。。PD-1靶点是研发非常火热的领域,恒瑞的卡瑞利珠单抗是国产新药的明星产品。根据相关统计,该药在国内预计年销售额峰值超过50亿元,期待其联合疗法在不同癌种中的优秀表现。