近日,和黄医药与武田宣布美国食品药品监督管理局(FDA)已受理 呋喹替尼用于治疗经治转移性结直肠癌成人患者的新药上市申请, 并予以优先审评 。
呋喹替尼是一种高选择性的口服血管内皮生长因子受体(VEGFR)1/2/3抑制剂抑制剂。2018年9月,呋喹替尼在我国获批上市,用于治疗转移性结直肠癌。这是首个从发现、研发到无附加条件获批均在我国完成的创新抗肿瘤药物。该创新药自2020年1月起获纳入中国国家医保药品目录。2023年1月23日,和黄医药宣布将呋喹替尼的中国外权益授权给武田制药,后者支付4亿美元预付款,以及7.3亿美元里程碑金额和一定比例的销售分成。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
2022年12月,和黄医药开始向美国FDA滚动提交呋喹替尼用于治疗难治性结直肠癌的新药上市申请,并于2023年3月完成提交。2023年5月,美国FDA宣布受理该新药上市申请,并予以优先审评。FDA就该新药上市申请拟定的处方药用户付费法案(PDUFA)目标审评时间为2023年11月30日。优先审评将有望加速呋喹替尼在美国的商业上市,并让全球患者更早从该药物中获得生存受益。
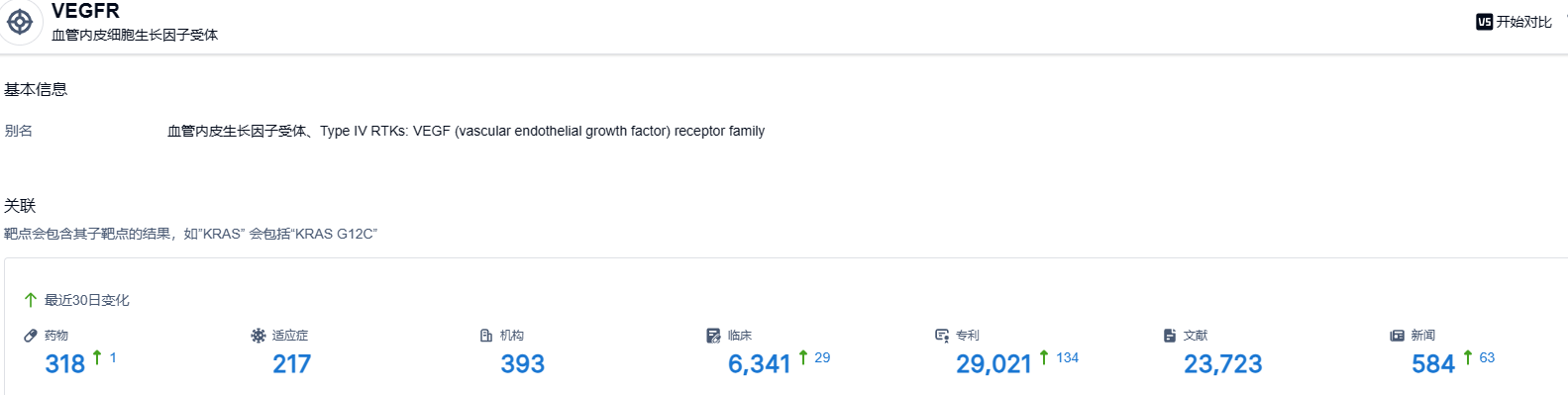
根据智慧芽新药情报库所披露的信息,截止到 2023 年6月8日,VEGFR 靶点共有在研药物318个,包含的适应症有217种,在研机构393家,涉及相关的临床试验6341件,专利多达29021件。。。VEGFR靶点是研发非常火热的领域,期待呋喹替尼这款国产新药能够成功获得美国FDA批准。