2023年6月8日,中国国家药监局药品审评中心(CDE)官网最新公示,瓴路药业申报的注射用loncastuximab tesirine拟纳入优先审评,拟用于治疗二线或多线系统治疗后复发或难治性大B细胞淋巴瘤成年患者。
Zynlonta(Loncastuximab、朗妥昔单抗)是ADCT公司研发的一种靶向CD19抗体偶联药物(ADC),于2021年4月获得美国FDA加速批准上市,用于治疗至少接受过2线及以上系统治疗的复发或难治性弥漫大B细胞淋巴瘤(r/r DLBCL)成年患者,包括非特定类型的DLBCL、低分化淋巴瘤转化的DLBCL和高级别B细胞淋巴瘤。。Zynlonta(Loncastuximab)是将抗 CD19 单克隆抗体与吡咯并苯并二氮(PBD)二聚体细胞毒性烷基化剂偶联在一起。PBD 进入细胞后通过不可逆地与 CD19 结合,在肿瘤细胞内释放出偶联物,其偶联物可与 DNA 结合,使得 DNA 双链产生交联,阻断 DNA 链的分离,随后诱导肿瘤细胞死亡。这是首款获得美国FDA批准的靶向CD19的抗体偶联药物(ADC),瓴路药业与ADC Therapeutics成立的合资公司瓴路爱迪思拥有该药在大中华区和新加坡的权益。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
2023年4月12日,由瓴路药业和ADC Therapeutics创立的合资企业瓴路爱迪思于宣布,旗下全球首个且唯一一个靶向CD19的抗体药物偶联物(ADC)药物Loncastuximab tesirine,在国内的II期注册临床试验OL-ADCT-402-001达到主要研究目的。该试验旨在评估Loncastuximab tesirine单药用于治疗复发/难治性弥漫大B细胞淋巴瘤(R/R DLBCL)中国患者的有效性和安全性。基于这个临床研究结果,该产品在国内的上市许可申请计划近期向中国国家药品监督管理局(NMPA)提交。
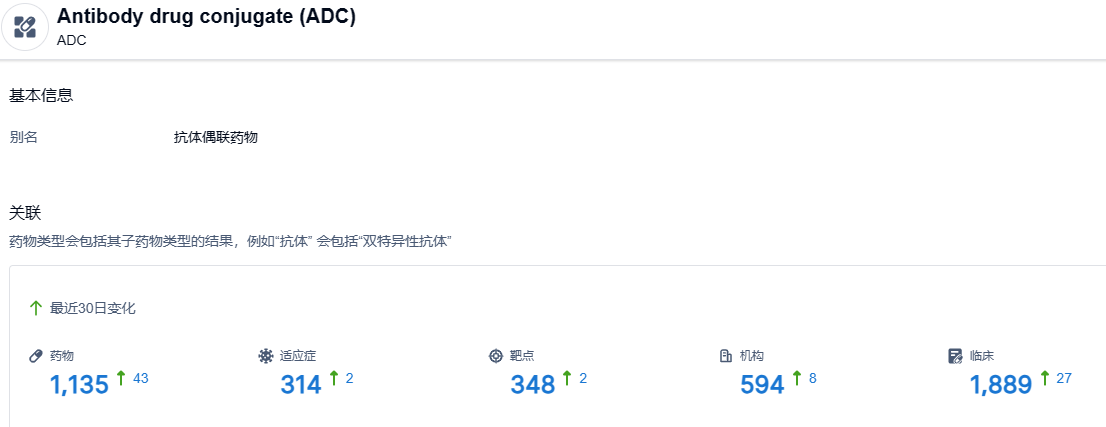
根据智慧芽新药情报库所披露的信息,截止到 2023 年6月9日,ADC这一药物类型共有在研药物1135个,包含的适应症有314种,靶点348个,在研机构594家,涉及相关的临床试验1889件。。。ADC药物等是目前研发热门的领域之一,期待更多国产新药的身影。