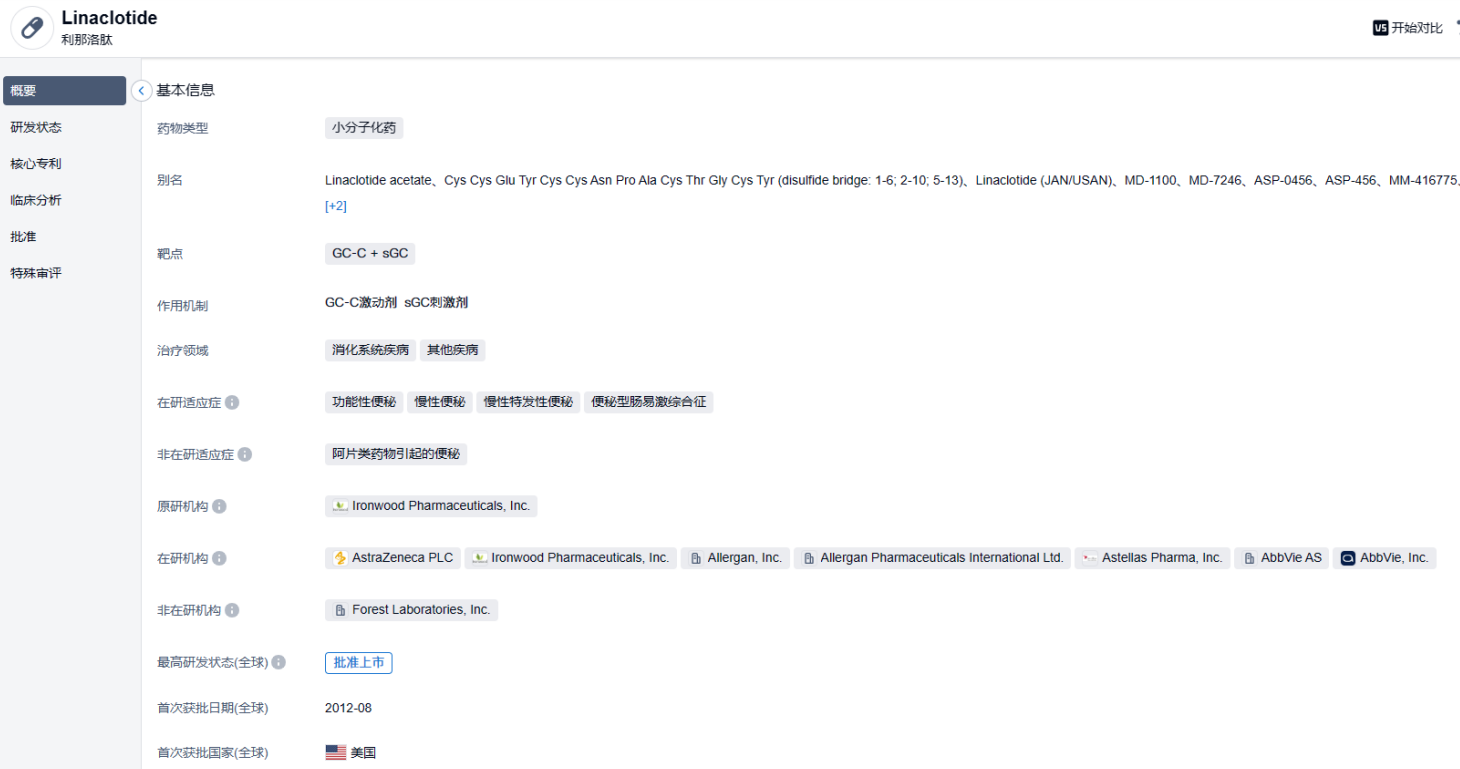
2023年6月12日,Ironwood Pharmaceuticals宣布,FDA已批准Linzess(linaclotide,利那洛肽)新适应症的上市申请,用于治疗6~17岁儿童功能性便秘(FC)。
利那洛肽是全球首个鸟苷酸环化酶-C(GC-C)受体激动剂类药物,此前已被FDA批准用于治疗成人便秘型肠易激综合征(IBS-C)与慢性特发性便秘(CIC)。该药于2019年1月15日被中国国家药品监督管理局(NMPA)批准用于治疗我国成人IBS-C,填补了中国IBS-C的治疗空白。在中国上市2年后,利那洛肽被纳入2020版药品目录。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
本次获批新适应症基于一项多中心、双盲的III期研究结果,旨在评估利那洛肽对6~17岁功能性便秘患者的疗效与安全性。该研究共纳入了328名患者,按1:1的比例随机接受利那洛肽 72μg或安慰剂治疗。结果显示,与安慰剂相比,利那洛肽在12周的自发排便频率(SBMs/周)上显示出具有统计学意义和临床意义的改善。与安慰剂组SBMs(1.050)相比,利那洛肽组患者每周SBMs (2.220) 与基线相比的最小二乘均值变化大于两倍 (p<0.0001)。安全性方面,研究中最常见的不良事件是腹泻,利那洛肽治疗组中腹泻发生率为4%,而安慰剂组为2%。
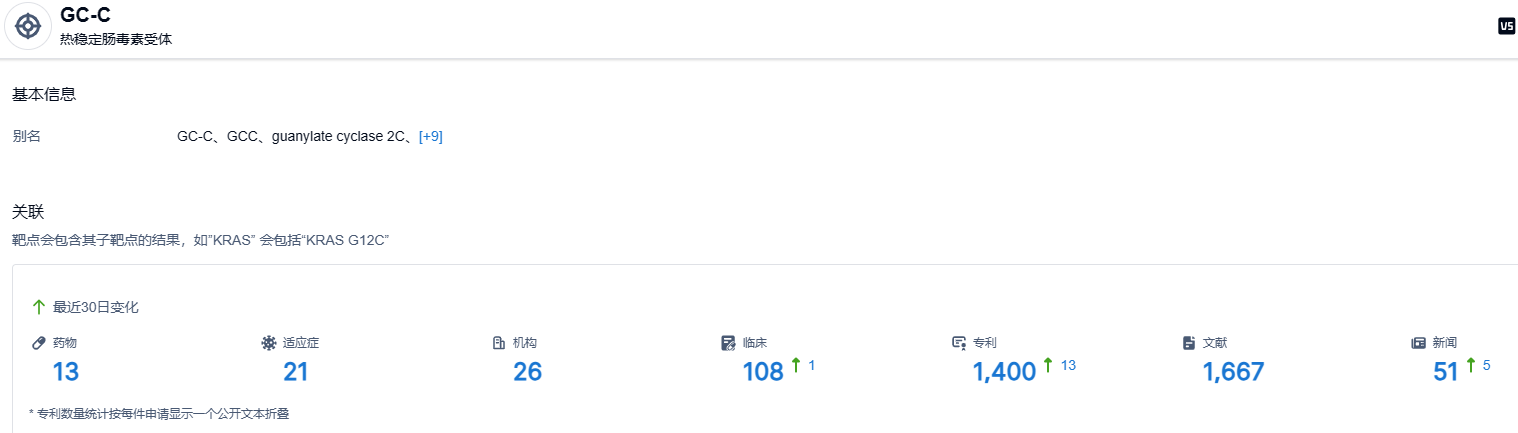
根据智慧芽新药情报库所披露的信息,截止到 2023 年6月15日,GC-C 靶点共有在研药物13个,包含的适应症有21种,在研机构26家,涉及相关的临床试验108件,专利多达1400件……利那洛肽新适应症的获批,给儿童便秘患者带来了新的治疗选择。