2023年6月16日,武田(Takeda)与和黄医药宣布,欧洲药品管理局(EMA)已确认并受理呋喹替尼用于治疗经治转移性结直肠癌成人患者的新药上市申请;同时,该产品治疗经治转移性结直肠癌的3期FRESCO-2研究结果于《柳叶刀》发表。此前,2023年5月26日,美国FDA已接受呋喹替尼用于治疗成年经治转移性结直肠癌患者的新药上市申请,并授予其优先审评资格,该申请的PDUFA日期定为2023年11月30日。
呋喹替尼是一种口服药物,属于高选择性和强效的VEGFR-1、-2和-3抑制剂。其独特设计旨在提高激酶选择性,以尽可能减少脱靶毒性,改善耐受性,并增强对靶点的稳定覆盖。呋喹替尼于2018年09月04日获NMPA批准上市,适用于既往接受过氟尿嘧啶类、奥沙利铂和伊立替康为基础的化疗,以及既往接受过或不适合接受抗血管内皮生长因子(VEGF)治疗、抗表皮生长因子受体(EGFR)治疗(RAS野生型)的转移性结直肠癌(mCRC)患者。2023年3月,武田与和黄医药达成了独家许可协议,该协议使得在中国大陆、香港和澳门以外的全球范围内推进呋喹替尼的开发、商业化和生产成为可能。此前,该药已在中国获得批准,用于治疗经过氟嘧啶、奥沙利铂和伊立替康治疗后的转移性结直肠癌患者。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
呋喹替尼的新药上市申请包含了3期FRESCO‑2研究以及中国3期FRESCO研究的结果。FRESCO 2研究是一项跨国多中心的3期国际临床试验,覆盖了美国、欧洲、日本和澳大利亚等地。该研究的目标是评估呋喹替尼联合最佳支持治疗(BSC)与安慰剂联合最佳支持治疗在治疗经治转移性结直肠癌患者中的疗效和安全性。研究结果显示,呋喹替尼治疗组在总生存期(OS)和无进展生存期(PFS)方面均取得了显著的统计学和临床意义上的改善,达到了主要终点和关键次要终点。此外,患者对呋喹替尼的耐受性普遍良好。FRESCO研究是一项随机、双盲、安慰剂对照的多中心3期临床研究,旨在评估呋喹替尼联合BSC与安慰剂联合BSC在转移性结直肠癌患者中的疗效和安全性。研究数据显示,呋喹替尼治疗组的中位总生存期(mOS)为9.3个月,较安慰剂组显著延长了2.7个月。此外,呋喹替尼组的中位无进展生存期(mPFS)延长了1.9个月,同时客观缓解率(ORR)和疾病控制率(DCR)也显著高于安慰剂组。这些结果成功达到了预设的全部终点。
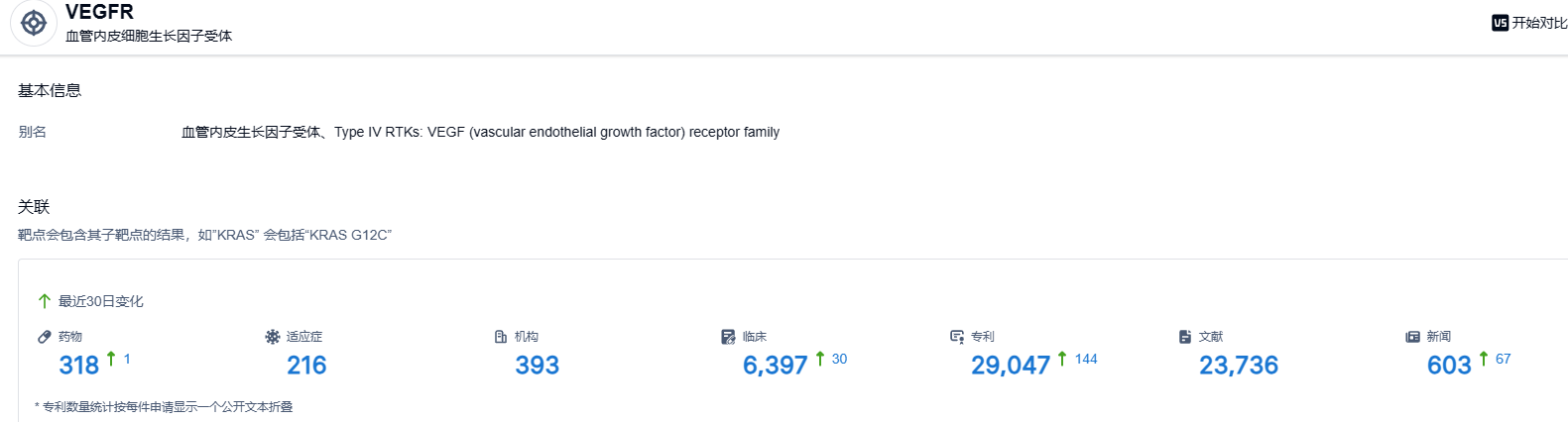
根据智慧芽新药情报库所披露的信息,截止到 2023 年6月17日,VGEFR 靶点共有在研药物318个,包含的适应症有216种,在研机构393家,涉及相关的临床试验6397件,专利多达29047件……呋喹替尼试验数据优秀,期待该药早日在国外上市,为国产新药出海增加浓墨重彩的一笔。