2023年6月15日,CDE药物临床试验登记与信息公示平台官网显示,科伦博泰登记了一项注射用A166对比注射用恩美曲妥珠单抗(T-DM1)在既往接受过曲妥珠单抗和紫杉类治疗的HER2阳性不可切除或转移性乳腺癌患者中的随机、开放、对照、多中心III期临床试验。
A166是科伦博泰研发的靶向HER2的创新ADC产品,能够靶向HER2表达的肿瘤细胞,通过内吞作用进入细胞后,在胞内溶酶体中被切割并释放毒素分子,从而高效杀伤肿瘤细胞。A166兼具抗体药物的靶向性以及化疗药物的高杀伤性等特点。该产品的上市申请已在今年5月获药监局受理,用于既往经二线及以上抗HER2治疗失败的HER2阳性不可切除的局部 晚期、复发或转移性乳腺癌。T-DM1是罗氏开发的一款HER2 ADC,早在2013年2月就已获FDA批准二线治疗HER2阳性乳腺癌,2020年1月开始进入中国市场。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
此次III期临床研究旨在评估A166( trastuzumab botidotin)相较于T-DM1在既往接受过曲妥珠单抗和紫杉类治疗的HER2阳性不可切除或转移性乳腺癌患者中的有效性,计划入组356名受试者,随机分组接受A166和T-DM1治疗。主要终点是由BICR采用RECIST 1.1评估的PFS(无进展生存期),次要终点包括OS(总生存期)、1年生存率、2年生存率和3年生存率、研究者评估的PFS以及BICR和研究者评估的ORR(客观缓解率)、DCR(疾病控制率)、DOR(缓解持续时间)和CBR(临床获益率)等。
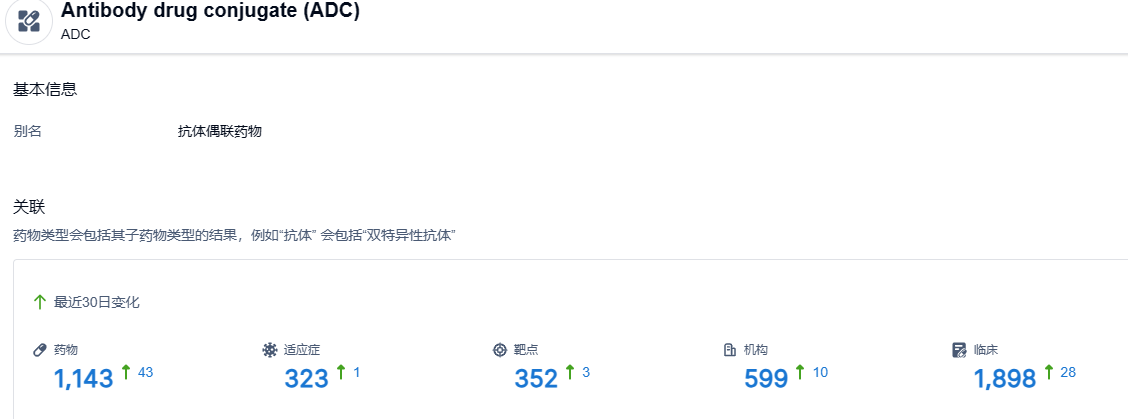
根据智慧芽新药情报库所披露的信息,截止到 2023 年6月17日,ADC这一药物类型共有在研药物1143个,包含的适应症有323种,靶点352个,在研机构599家,涉及相关的临床试验1898件……A166是科伦博泰首个提交上市许可申请的ADC产品,期待这款国产ADC新药能够顺利上市.