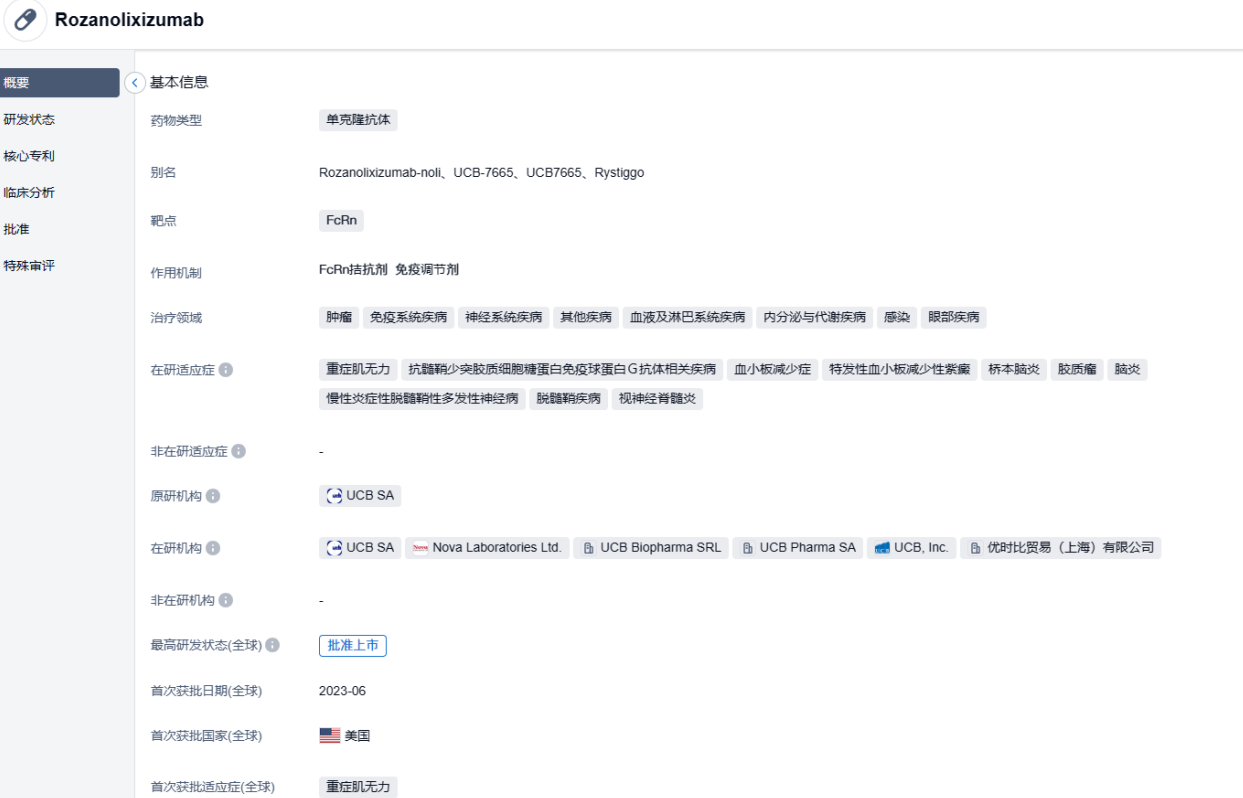
2023年6月27日,优时比(UCB)宣布,美国FDA已批准该公司皮下注射靶向新生儿Fc受体(FcRn)单抗Rystiggo(rozanolixizumab)上市,用于治疗抗乙酰胆碱受体(AChR)或抗肌肉特异性酪氨酸激酶(MuSK)抗体阳性成人全身型重症肌无力(gMG)。
rozanolixizumab是由优时比开发的FcRn靶向单抗,以高亲和力特异性结合人类FcRn,通过阻断FcRn和IgG的相互作用,来加速IgG的分解代谢,降低致病性IgG自身抗体的水平。目前,rozanolixizumab正被开发通过驱动致病性IgG自身抗体的清除,来治疗多种由致病性IgG自身抗体驱动的自身免疫性疾病,包括gMG、原发性免疫性血小板减少症(ITP)、抗髓鞘少突胶质细胞糖蛋白免疫球蛋白G抗体(MOG-IgG)相关疾病(MOGAD)、自身免疫性脑炎(AIE)。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
此次批准是基于关键的III期MycarinG研究数据,在该研究中,rozanolixumab在AChR MuSK抗体阳性MG患者的MG特异性结局中显示出显著统计学和临床意义上的改善。从基线到第43天,rozanolixizumab显著降低MG-ADL(重症肌无力日常生活活动)评分。此外,与安慰剂组相比,rozanollizumab(7mg/kg和10mg/kg)组患者MG-ADL改善≥2分患者比例更高(p<0.001),定量重症肌无力量表(QMG)评分改善≥3分以及重症肌无力综合评分改善≥3分的患者比例也更高,说明这些评估指标的改善具有临床意义。Rozanollizumab显示出可接受的安全性和耐受性,两个剂量间TEAE发生率相似。与安慰剂组相比,rozanollizumab组TEAE发生率更高 (7mg/kg组81.3%,10mg/kg组82.6%,安慰剂组67.2%)。最常见的TEAE为头痛、腹泻、发热和恶心。据报道,与安慰剂组相比,rozanollizumab组头痛发生率更高,大多数为轻中度,重度病例通常使用非阿片类镇痛药进行治疗。
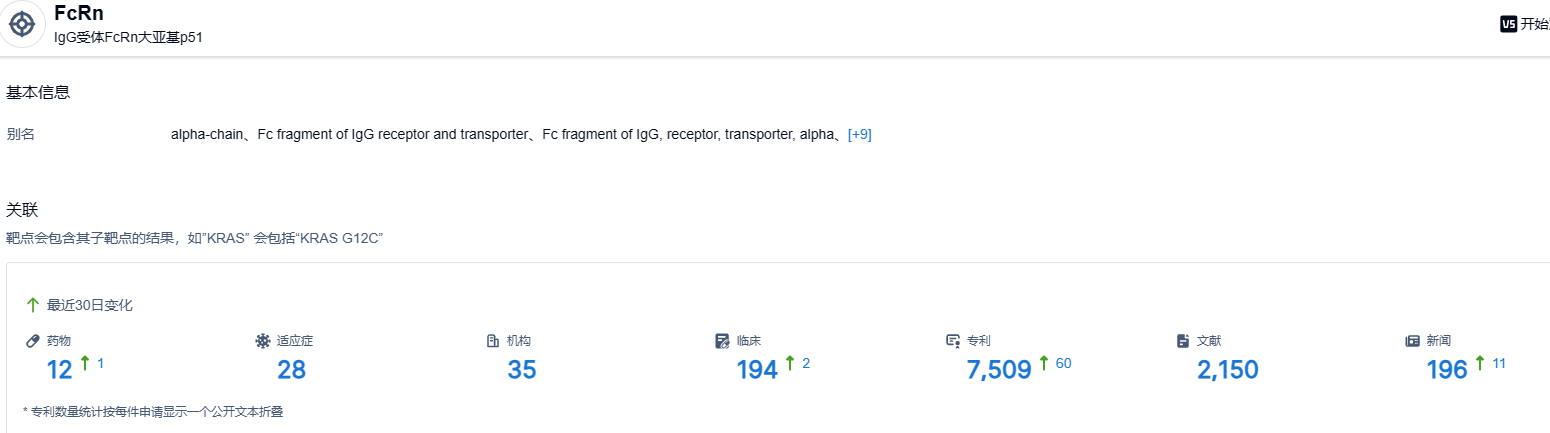
根据智慧芽新药情报库所披露的信息 ,截止到 2023 年6月29日,FcRn靶点共有在研药物12个,包含的适应症有28种,在研机构35家,涉及相关的临床试验194件,专利多达7509件……FcRn靶点药物的开发尚处于蓝海阶段,期待更多新药的获批。