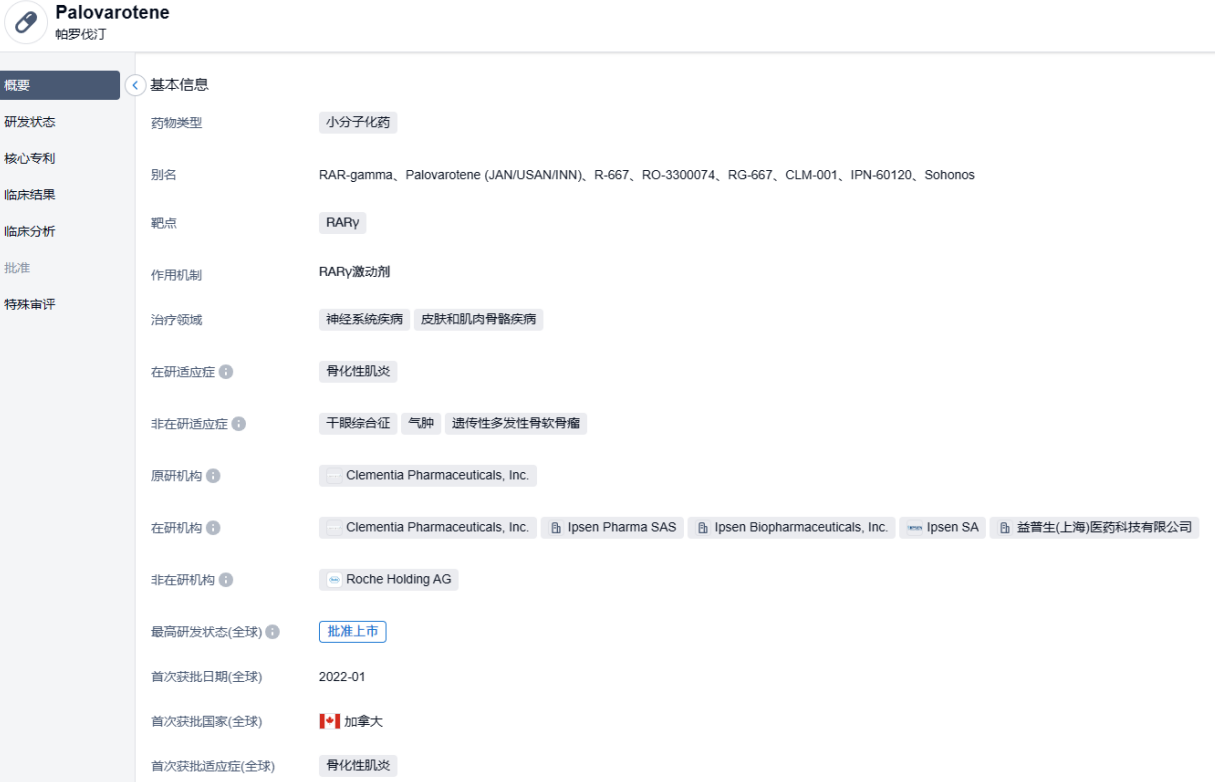
近日,益普生(Ipsen)宣布美国FDA的内分泌和代谢药物咨询委员会(EMDAC)投票赞成将其在研药物palovarotene作为一种超罕见疾病——进行性肌肉骨化症(FOP)的有效治疗方法。如果获得批准,palovarotene将成为FDA批准的首个治疗FOP的药物。
Palovarotene是一种口服、高选择性视黄酸受体γ(RARγ)激动剂,视黄酸受体γ(RARγ)是类视黄醇信号通路中骨骼发育和异位骨的重要调节因子。Palovarotene旨在介导类视黄醇信号通路内受体、生长因子和蛋白质之间的相互作用,以减少新的异常骨形成 (HO)。此前,FDA曾授予Palovarotene“孤儿药”称号和突破性疗法认定,且被授予优先审查资格。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
这一NDA是基于名为MOVE的3期临床试验结果,试验数据显示,与未经治疗组患者(n=98)相比,palovarotene组患者(n=97)的异位骨化(heterotopic ossification)比率下降了62%。此前,该药曾获美国FDA的罕见儿科疾病认定与突破性疗法认定。目前palovarotene已获加拿大批准上市,并于2022年6月向欧盟EMA提出上市许可申请(MAA)。
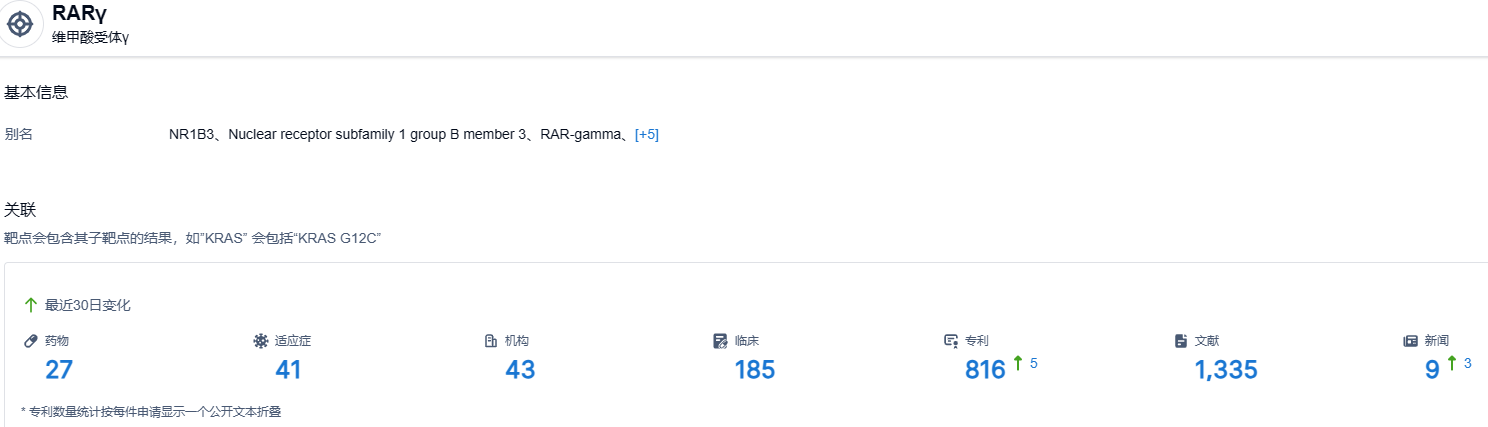
根据智慧芽新药情报库所披露的信息,截止到 2023 年7月7日,RARγ靶点共有在研药物27个,包含的适应症有41种,在研机构43家,涉及相关的临床试验185件,专利多达816件……期待这款罕见病新药能够成功上市,给患者带来新的治疗选择。