2023年7月12日,第一三共和阿斯利康共同宣布,优赫得®(ENHERTU®,注射用德曲妥珠单抗,Trastuzumab deruxtecan)获 NMPA 批准,单药适用于治疗既往在转移性疾病阶段接受过至少一种系统治疗的,或在辅助化疗期间或完成辅助化疗之后 6 个月内复发的,不可切除或转移性 HER2 低表达(IHC 1+或 IHC 2+/ISH-)成人乳腺癌患者。这意味着国内患者从此获得了首款用于 HER2 低表达乳腺癌的 HER2 靶向疗法。
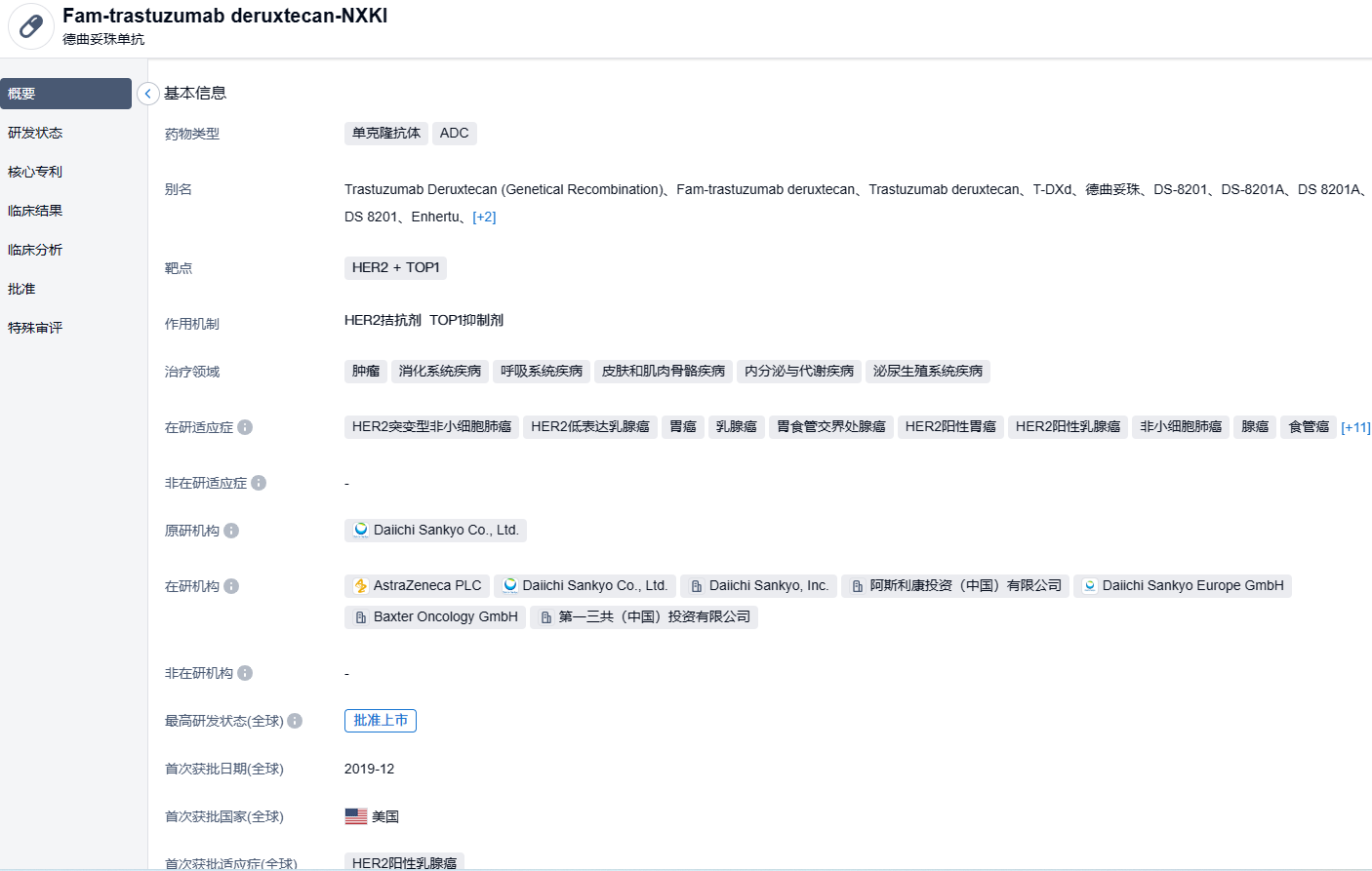
德曲妥珠单抗(Trastuzumab deruxtecan)(研发代号:DS-8201)由抗HER2人源化单克隆抗体与载药拓扑异构酶Ⅰ抑制剂DXd(payload)通过可裂解连接子(linker)组成,其DAR值达理论最大值8,具有避免耐药、特异性强、高细胞毒性和安全性良好的特点。与HER2结合后,德曲妥珠单抗会破坏HER2信号,介导抗体依赖的细胞毒性反应,并通过内吞进入细胞内释放DXd,进而导致DNA损伤和细胞凋亡。此外,连接子与载药连接处的自切割修饰赋予的高效膜透过性,使德曲妥珠单抗能够发挥“旁观者效应”,克服瘤内异质性。本品最早由第一三共开发。2019年3月,阿斯利康与第一三共达成一项高达69亿美元的合作,在全球范围内共同开发和商业推广德曲妥珠单抗。2023年2月,注射用德曲妥珠单抗获得NMPA批准上市,单药适用于治疗既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌患者。本次获批基于DESTINY-Breast03临床试验研究获得的结果。
 (文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
此次新适应症的获批是基于 DESTINY-Breast04 的 III 期临床研究结果。该试验结果首次于 2022 年美国临床肿瘤学会(ASCO)年会上发布,并发表于《新英格兰医学杂志》。此项批准前,中国国家药品监督管理局于 2023 年 2 月已批准了优赫得®适用于治疗既往接受过一种或一种以上抗 HER2 药物治疗的不可切除或转移性 HER2 阳性成人乳腺癌患者。根据 DESTINY-Breast04 研究结果显示,与化疗相比,优赫得®治疗组将 HR 阳性及 HR 阴性的 HER2 低表达乳腺癌患者的疾病进展或死亡风险降低了 50%(危险比 [HR]=0.50;95% 置信区间 [CI]:0.40-0.63;p<0.0001)。通过盲态独立中心审查(BICR)评估,优赫得®治疗组的中位无进展生存期(PFS)为 9.9 个月(95%CI:9.0-11.3),而化疗组仅为 5.1 个月(95%CI:4.2-6.8),死亡风险降低 36%(HR=0.64;95%CI:0.49-0.84;p=0.001),接受优赫得®治疗的患者的中位总生存期(OS)为 23.4 个月(95%CI:20.0-24.8),而化疗组为 16.8 个月。
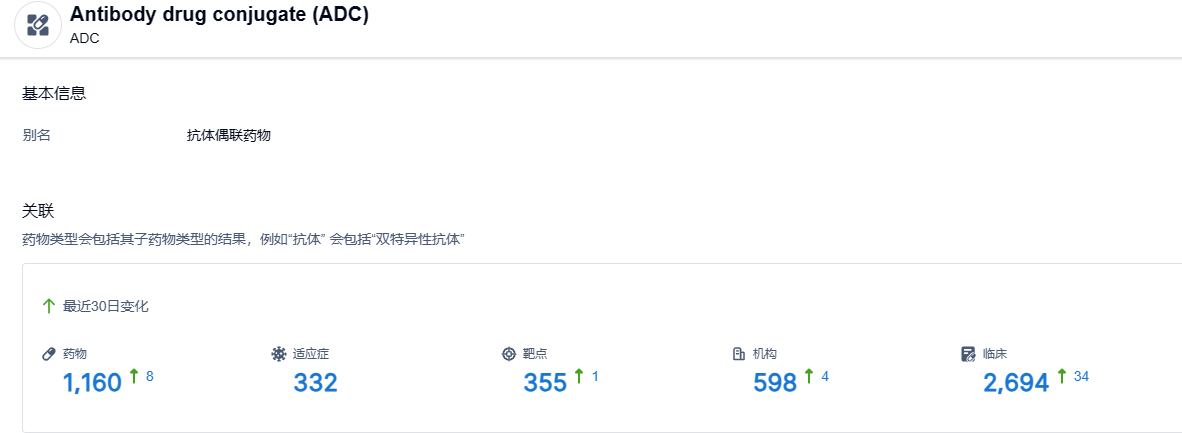
根据智慧芽新药情报库所披露的信息 ,截止到 2023 年7月13日,ADC这一药物类型共有在研药物1160个,包含的适应症有332种,靶点355个,在研机构598家,涉及相关的临床试验2694件……期待德曲妥珠单抗的后续表现。