近期,美国食品药品监督管理局(FDA)宣布已完全批准Blueprint Medicines和基因泰克(Genentech)联合研发的Gavreto(pralsetinib)药物,用于治疗已经接受FDA认定的RET融合检测且结果为阳性的成年非小细胞肺癌(NSCLC)患者。
Pralsetinib是由美国Blueprint Medicines公司研发的口服药物,每日一次,具有强效和高选择性,可以靶向抑制RET基因的变异。它可以特异性地强力抑制多种癌症类型中的RET基因变异。该药物曾获得美国FDA授予的孤儿药和突破性疗法认定,并于2020年9月获得FDA加速批准,用于治疗RET融合阳性成年NSCLC患者。之前的加速批准是基于ARROW试验的1/2期研究结果,涵盖了114名患者:在接受过铂类化疗的患者中,有57%的患者肿瘤明显缩小,其中5.7%的患者肿瘤完全消失;在之前没有接受过其他治疗的患者中,有70%的患者肿瘤明显缩小,其中11%的患者肿瘤完全消失。
 (文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
此次完全批准是基于237例局部晚期或转移性RET融合阳性NSCLC患者的疗效数据。这些患者接受Gavreto治疗,直至疾病进展或出现无法接受的毒性。主要疗效指标是设盲独立审评委员会(BIRC)确定的总缓解率(ORR)和缓解持续时间(DOR)。在107例初治患者中,ORR为78%,中位DOR为13.4个月。在130例曾接受含铂化疗的患者中,ORR为63%,中位DOR为38.8个月。最常见的不良反应(发生率≥25%)为肌肉骨骼疼痛、便秘、高血压、腹泻、疲乏、水肿、发热和咳嗽。
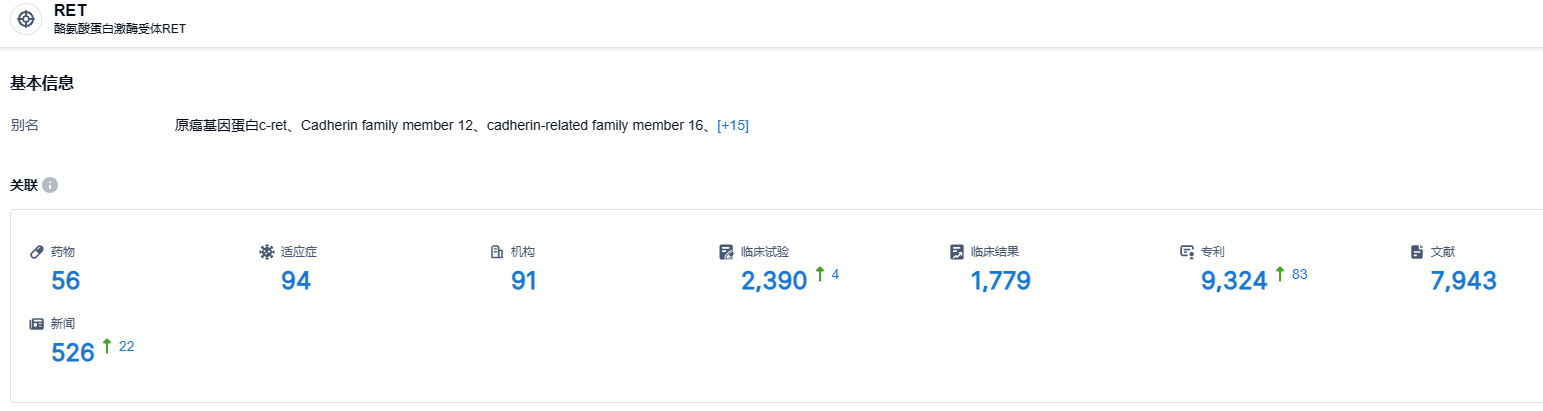
根据智慧芽新药情报库的数据,截至2023年8月12日,针对RET靶点正在研发的药物共有56个,适应症涵盖94种,研发机构为91家,相关的临床试验多达2390件,相关专利高达1779件。Pralsetinib作为高选择性的靶向药物,能够精确打击RET基因变异,在NSCLC、甲状腺C和其他RET基因变异的实体瘤患者中显示出积极疗效和良好安全性。这一疗法有望成为突破性的治疗药物。