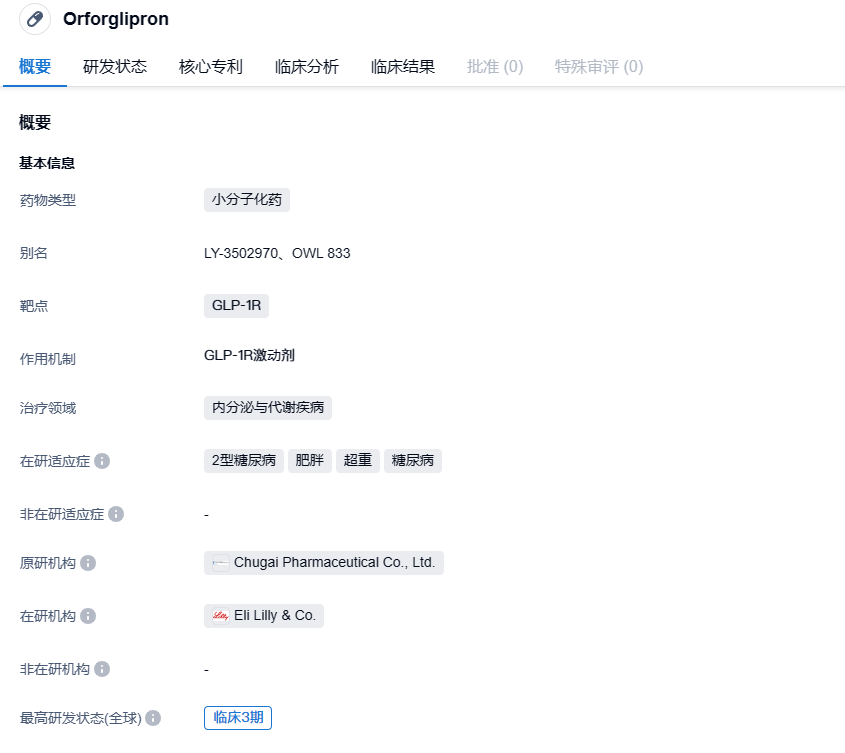
根据中国药物临床试验登记与信息公示平台(中国CTRI)的数据,美国制药公司礼来(Eli Lilly and Company)已开始一项名为ATTAIN-1的国际多中心三期临床研究,以评估其药物LY3502970(也称为Orforglipron)在肥胖或超重并伴有体重相关合并症的患者中的疗效和安全性。
Orforglipron是一种新型口服非肽类GLP-1R激动剂,由中外制药研发。2018年,礼来公司与中外制药合作,以5千万美元的首付款获得了Orforglipron的全球开发和商业化权益。除了用于肥胖症,Orforglipron还在开发中用于治疗2型糖尿病。礼来公司已经开展了多项关于Orforglipron的三期临床研究,以研究其在肥胖/超重(ATTAIN系列)和2型糖尿病(ACHIEVE系列)方面的疗效和安全性。最近,礼来公司在ClinicalTrials.gov上注册了一个名为ACHIEVE-1的三期临床研究,以评估Orforglipron对于那些无法通过运动和饮食控制血糖的2型糖尿病成年患者的疗效。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
这次新启动的ATTAIN-1研究是一项国际性的三期、随机、双盲研究,旨在评估每日一次口服Orforglipron与安慰剂相比对肥胖或超重合并体重相关合并症的成年患者的疗效和安全性。该研究的主要目标是证明每日6mg、12mg和/或36mg的Orforglipron相较于安慰剂,在体重控制方面具有更好的效果。预计全球范围内将有3000名受试者参与此研究,其中中国的受试者人数将达到280人。
2023年6月23日,礼来公司发布了首款非肽类口服胰高血糖素样肽-1(GLP-1)受体激动剂orforglipron的最新II期临床试验数据。该研究旨在评估orforglipron在肥胖或超重患者的慢性体重管理方面的疗效。这些研究结果不仅在美国糖尿病协会第83届科学会议上进行了口头报告,还同时发表在《新英格兰医学杂志》上。
在第26周的主要终点评估中,接受不同剂量(12mg、24mg、36mg或45mg)orforglipron治疗的患者均表现出具有统计学意义的剂量依赖性体重减轻效果。减重幅度从8.6%(相当于19.8磅或9.0公斤)至12.6%(相当于29.3磅或13.3公斤),而安慰剂组的减重幅度仅为2.0%(相当于4.6磅或2.1公斤)。对于接受orforglipron治疗的受试者,36周时体重持续下降,所有剂量组的体重都有所减少。减重范围从9.4%(相当于21.6磅或9.8公斤)至14.7%(相当于34.0磅或15.4公斤),而安慰剂组的体重减少了2.3%(相当于5.3磅或2.4公斤)。受试者的平均基线体重为240磅(约109公斤)。此外,orforglipron的安全性与其他基于肠促胰岛素的治疗方法相似。胃肠道副作用是最常见的不良事件,严重程度通常为轻度至中度,并且通常发生在剂量递增期间。
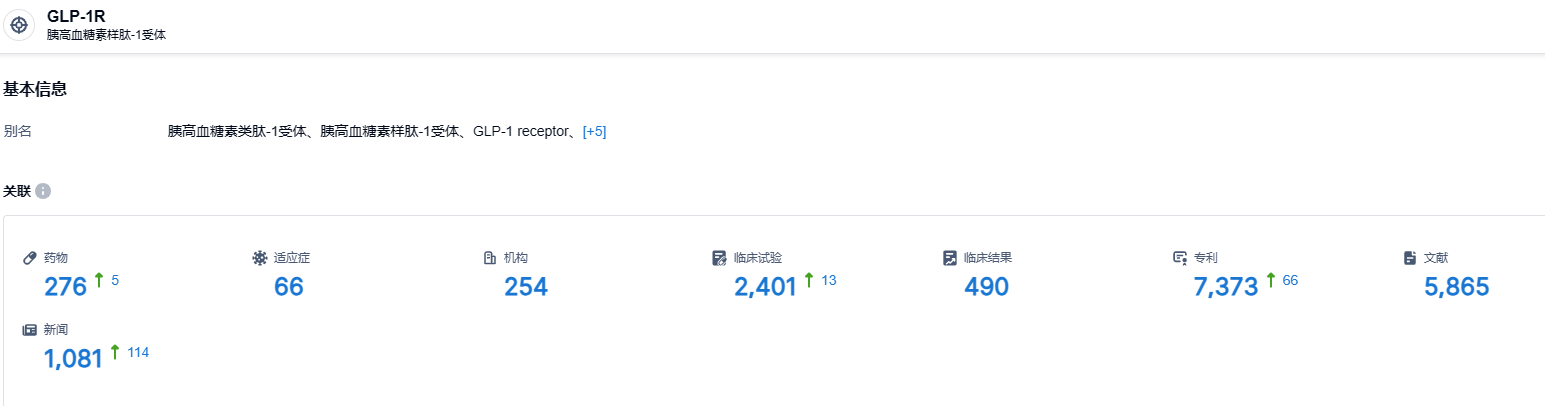
根据中国药物临床试验登记与信息公示平台官网公示的信息,截至2023年8月12日,GLP-1R靶点目前有276个在研药物,涵盖了66种不同的适应症。这些研究涉及了来自254家不同机构的临床试验,总计有2401项相关的试验正在进行中。此外,已有7373项专利与GLP-1受体新药相关。这些研究表明,GLP-1受体新药在降糖、减重等领域具备巨大的治疗潜力。Orforglipron的上述三期研究是一个重要的进展,礼来公司在GLP-1R领域的药物管线也十分广泛,目前正在进行的或计划中的研究项目众多,对于这类疾病的治疗可能会带来积极的影响。