最近,Amgen宣布,美国FDA肿瘤学药物咨询委员会(ODAC)将审评支持将KRAS G12C抑制剂Lumakras(sotorasib)的加速批准转化为全面批准的临床试验数据。预计,该委员会的会议将于今年10月5日召开。
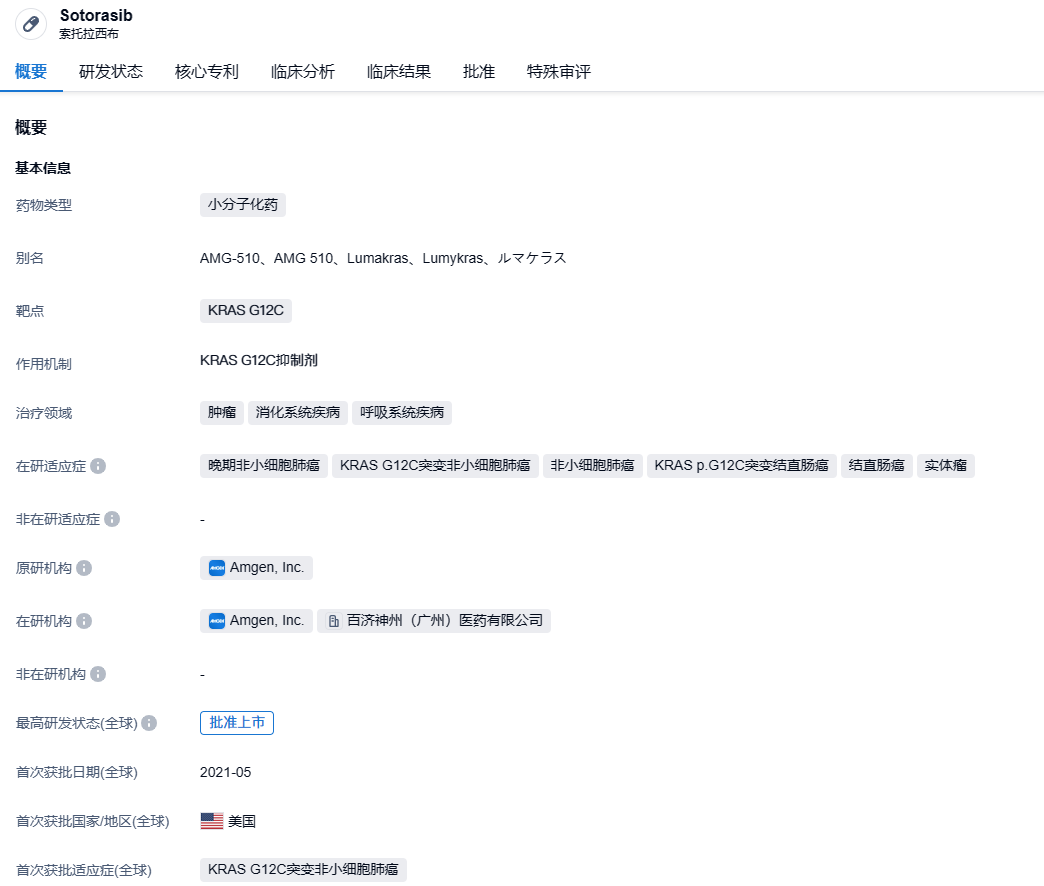
sotorasib是Carmot Therapeutics和Amgen合作研发的一款KRAS G12C抑制剂,该药在中国的商业化权利已被百济神州独家获得。sotorasib(AMG-510)于2021年5月得到美国食品药品监督管理局(FDA)的批准上市,被用于治疗已接受过至少一种全身治疗的KRAS G12C突变型局部晚期或转移性非小细胞肺癌(NSCLC)成人患者(通过FDA批准的检测方式确定)。这是全球首个针对KRAS突变的抗癌药物。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
在 2022 年 9 月,安进公布了CodeBreaK 200 三期临床试验的结果。与标准化疗相比,Lumakras能够使患者疾病进展或死亡的风险减少34%(HR:0.66,[95% CI:0.51,0.86];P=0.002)。在治疗一年后,Lumakras的无进展生存率为25%,而接受化疗的患者中这一数值仅为10%。此外,Lumakras也实现了客观减轻率(ORR)的次要终点,Lumakras的ORR为28%,而化疗患者的ORR为13%(P<0.001)。Lumakras同时提高了疾病的控制率(83%对60%)。在这些数据的基础上,安进已提交了将Lumakras的加速批准转为完全批准的补充新药申请(sNDA),预计FDA将在今年12月24日前做出评审结果。
2023年6月27日,clinicaltrials.gov网站记录了一项由安进进行的III期临床试验(CodeBreaK 202),旨在评估Sotorasib(商品名:Lumakras)联合化疗与帕博利珠单抗(K药)联合化疗一线治疗IV期或IIIB/C期非鳞状非小细胞肺癌(NSCLC)患者的有效性和安全性。这项研究属于多中心、随机、开放标签的临床试验,计划纳入750个PD-L1阴性、KRAS p.G12C阳性的非鳞状 NSCLC 患者。研究的主要终点是无进展生存期(PFS)。计划从2023年9月开始并预计会持续到2030年11月。
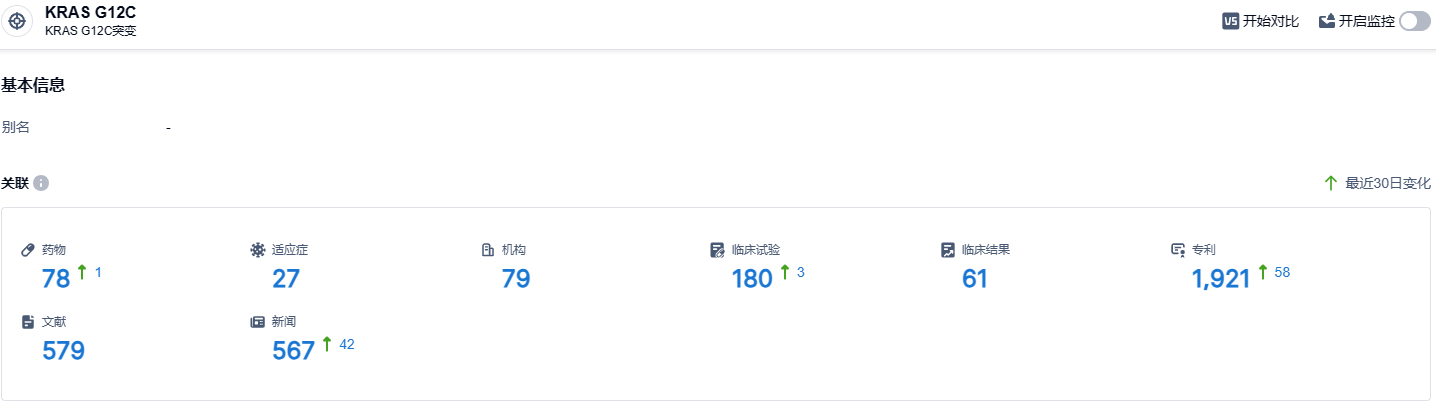
根据智慧芽新药情报库所披露的信息,截止到 2023 年8月24日,KRAS G12C靶点已经有78款在研药物,涵盖27种适应症,有79家研发机构,相关的临床试验达180件,专利多达1921项……FDA目前已批准上市了两款KRAS G12C抑制剂,此外还有大量的KRAS G12C抑制剂处于临床阶段。KRAS G12C这个曾经被视为“无法成药”的靶点,现在已经成为其中一个被广泛瞩目的“可成药”靶点。