近期,《新英格兰医学杂志》公布了由罗氏旗下的基因泰克公司开发的KRAS G12C抑制剂divarasib(RG6330/GDC-6036)的一期临床试验结果。这项研究发表的论文表明,divarasib在KRAS G12C阳性肿瘤中能够产生持续的临床缓解效果。
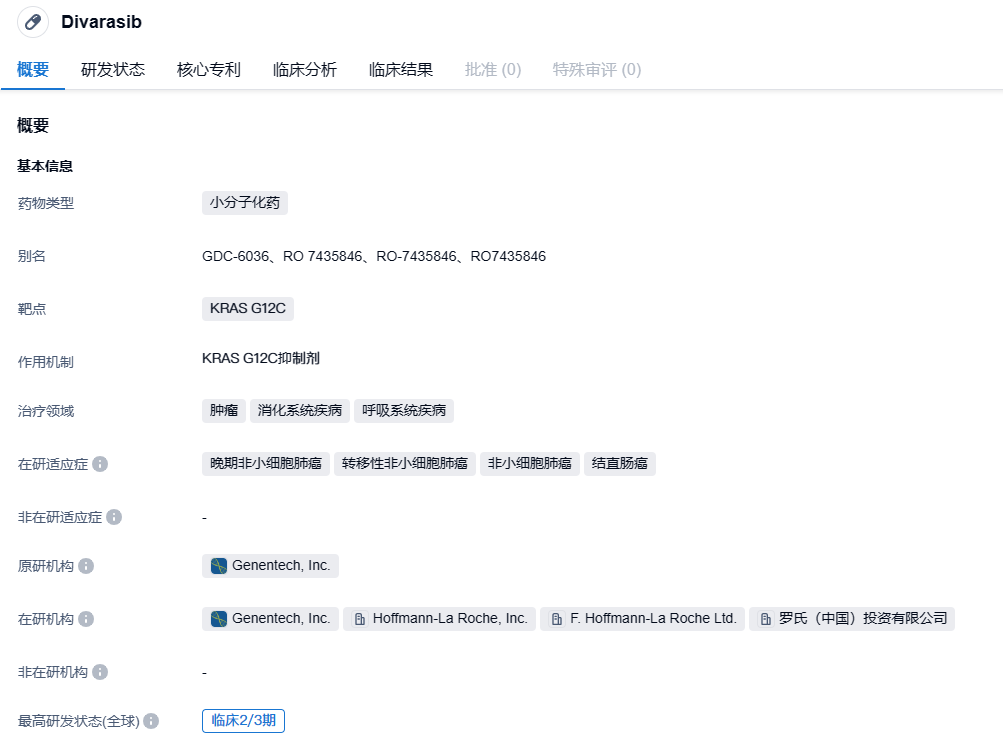
divarasib(RG6330/GDC-6036)是罗氏计划开发的一款新型KRAS G12C抑制剂,其针对KRAS G12C突变的非小细胞肺癌(NSCLC)的治疗已进入临床 II/III 期。临床前研究结果显示,divarasib能有效选择性抑制KRAS G12C蛋白。该药物通过使突变的KRAS G12C保持失活状态,关闭致癌信号,从而达到抑制肿瘤生长的效果。divarasib在体外试验中的效果大约比已经被FDA认可的KRAS G12C抑制剂Lumakras和Krazati在结直肠癌(CRC)中的效果高出5~20倍,选择性大约在10~50倍。并且,400毫克剂量的divarasib的药代动力学特征与西妥昔单抗相当,在试验中没有发现药物间的相互作用。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
该1期试验旨在对携带KRAS G12C突变的晚期或转移性实体肿瘤患者每日口服divarasib(剂量范围为50-400 mg)的效果进行评价。重点评估药物的安全性,同时结合药代动力学进行研究并观察抗肿瘤活性及病人缓解和药物抗性的生物标志物。试验共有137名参与者(包含60名NSCLC患者、55名结直肠癌患者和22名其它实体肿瘤患者)。基于分析,NSCLC患者中,53.4%的人实现了确证的缓解(95% CI:39.9-66.7),中位无进展生存期达到13.1个月(95% CI:8.8-无法估计)。而在结直肠癌患者中,29.1%的人实现了确证的缓解(95% CI,17.6-42.9),中位无进展生存时间为5.6个月(95% CI:4.1-8.2)。其它实体肿瘤患者同样有缓解情况。此外,针对循环肿瘤DNA的评估显示KRAS G12C变异等位基因频率下降,可能显示病人出现缓解。研究也发现了与divarasib耐药性相关的基因组变异。在安全性上,93%的患者(127名)出现了治疗相关不良事件,11%的患者(15名)出现3级事件,1名患者(1%)出现4级事件。14%的患者(19名)由于治疗相关副作用事件而需要减少药物剂量,3%的患者(4名)需停止治疗。
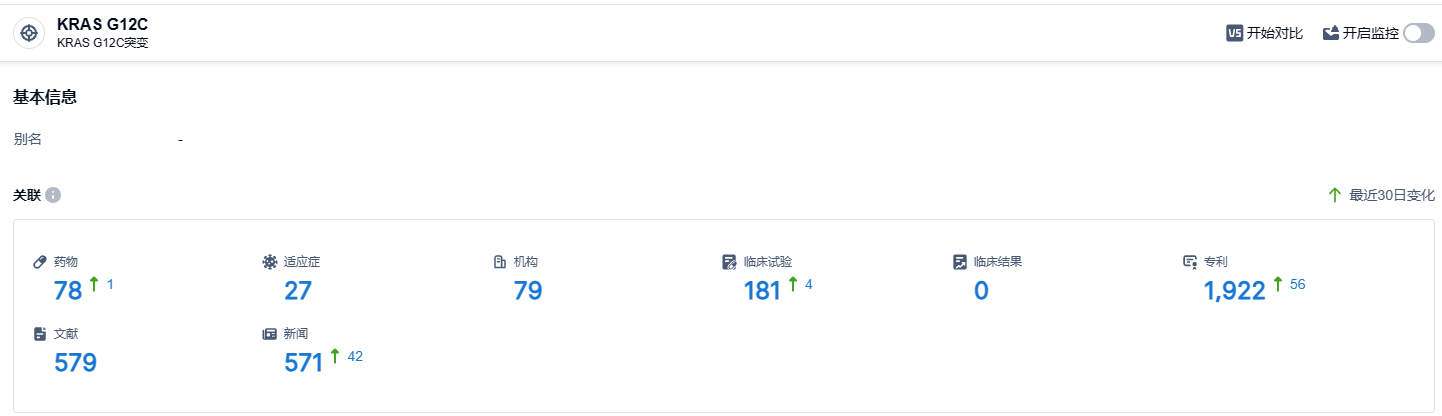
根据智慧芽新药情报库所披露的信息,截止到2023年8月24日,针对KRAS G12C靶点的正在研发的药物有78种,包含27种适应症,涉及的机构有79家,相关的临床试验有181例,而且还有1922项专利。目前,FDA已经批准了两款KRAS G12C抑制剂,许多国内外的KRAS G12C抑制剂仍处于临床阶段。曾经被认为是“无法成药”的KRAS G12C,如今已成为热门的治疗靶标之一。