在2023年8月29日,基石药业发布公告,舒格利单抗注射液和化疗的联合疗法在一线治疗无法手术切除的PD-L1表达≥5%的局部晚期或者转移性胃/胃食管结合部腺癌的3期研究(GEMSTONE-303)中,实现了总生存期(OS)主要研究终点。与安慰剂联合化疗的对照组相比,舒格利单抗和化疗的联合使用能显著提高病人的总生存期,差异在统计学上有显著性,并具有临床意义。GEMSTONE-303研究已经实现了预设的无进展生存期(PFS)和OS双重目标,以及关键的次要终点。
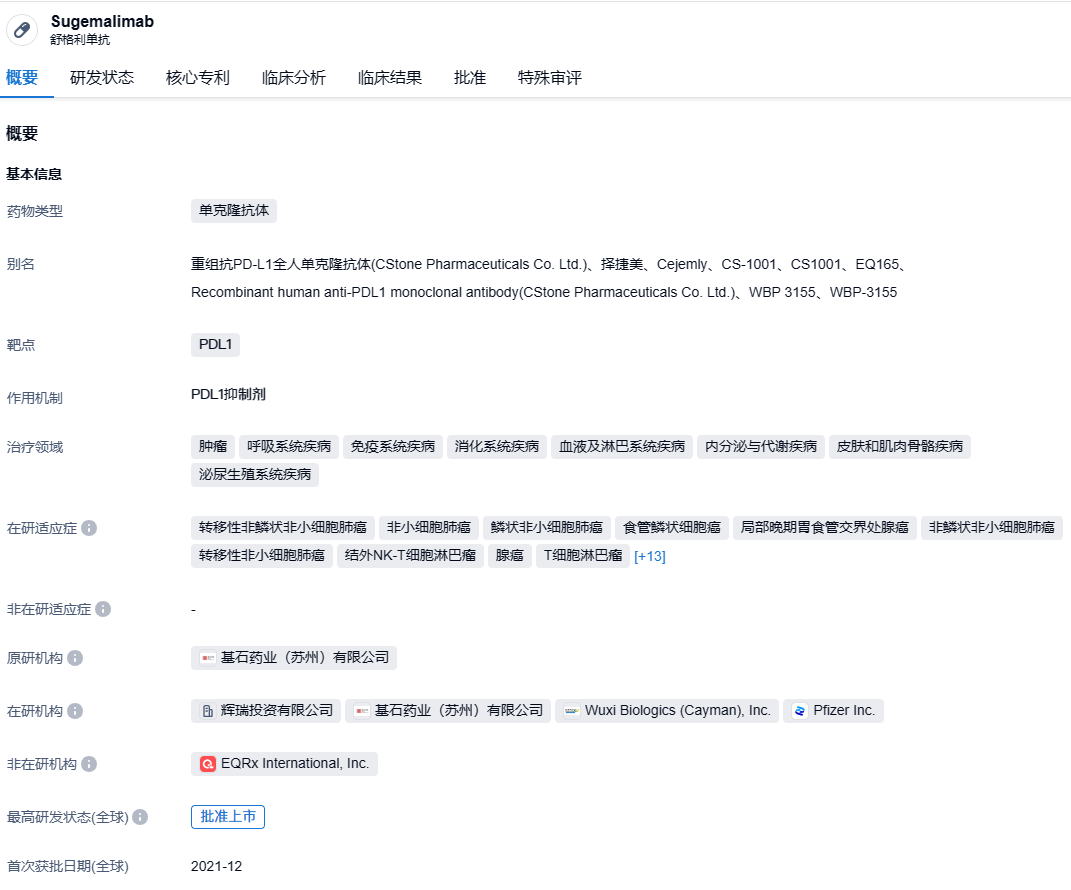
舒格利单抗(商品名:择捷美®)是基石药业自主研发的抗PD-L1单抗药物,目前已经在中国获得了两个适应症审批。 这两个适应症分别是:结合培美曲塞和卡铂,作为转移性非鳞状非小细胞肺癌患者的一线治疗(EGFR基因突变阴性和ALK阴性);和紫杉醇、卡铂联用,用于一线治疗转移性鳞状非小细胞肺癌(于2021年12月获批);以及作为不可切除的III期非小细胞肺癌(NSCLC)患者在同步或序贯放化疗后未发生疾病进展的巩固治疗(于2022年5月获批)。值得一提的是,舒格利单抗已经被纳入《2022版CSCO非小细胞肺癌诊疗指南》,推荐作为IV期无驱动基因非鳞/鳞状NSCLC患者的化疗一线疗法,以及III期NSCLC患者在同步或序贯放化疗后的巩固治疗。2023年2月,NMPA接受了舒格利单抗和化疗联合作为一线治疗不可手术切除的晚期或者转移性胃/胃食管结合部腺癌新适应症的上市申请,尚在审查过程中。
 (文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
GEMSTONE-303是一项多中心、随机、安慰剂对照的3期注册性临床试验,目的在于评估舒格利单抗联合CAPOX化疗方案(奥沙利铂+卡培他滨)作为无法手术切除的PD-L1表达≥5%的局部晚期或转移性胃腺癌或胃食管结合部腺癌一线治疗的疗效和安全性。主要的研究终点是研究者评价的PFS和OS,次要的研究终点包括由盲态独立中心审阅委员会评估的PFS,以及研究者评价的客观缓解率(ORR)和缓解持续时间(DoR)。在2022年11月,GEMSTONE-303研究实现了PFS主要研究终点,在OS的期中分析中显示出明显的治疗效果。与安慰剂联合化疗的对照组相比,舒格利单抗和化疗的联合使用显著改善了研究者评估的PFS,差异具有统计学上的显著性和临床意义。
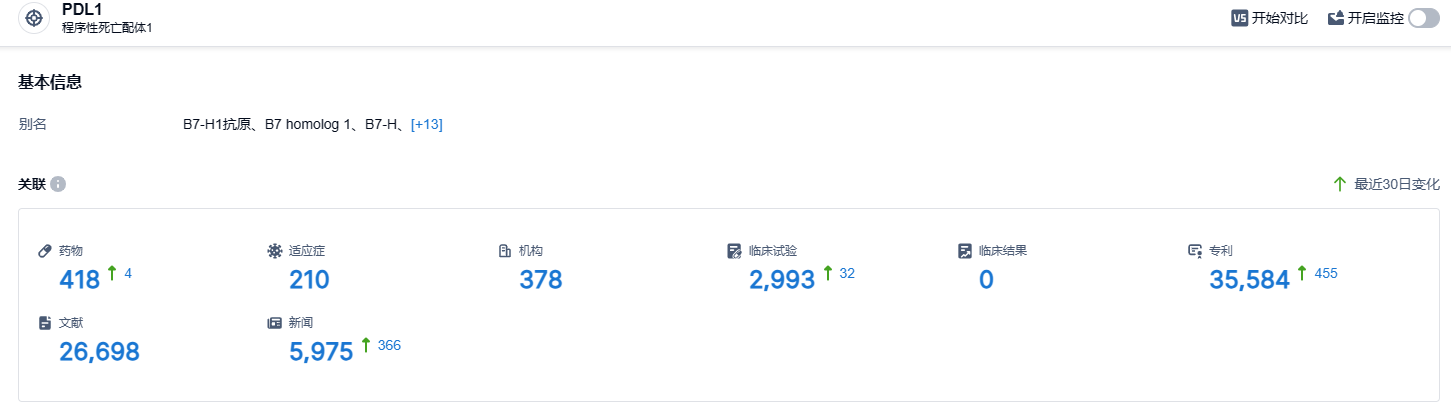
根据智慧芽新药情报库所披露的信息,到2023年8月30日,PD-L1靶点共有418个在研药物、涵盖210种适应症、378个研究机构、进行2993次临床试验,高达35584件的专利……在2020年10月,基石药业将舒格利单抗和抗PD-1单抗CS1003在大中华区以外地区的开发和商业化权益授权给了EQRx公司,这笔交易涉及的金额超过13亿美元。EQRx公司已经向英国药品和医疗保健用品管理局(MHRA)和欧洲药品管理局(EMA)提交了舒格利单抗联合化疗一线治疗转移性NSCLC的上市许可申请,期待能在全球市场实现舒格利单抗的成功上市。