在2023年9月6日,罗氏子公司Genentech宣布,他们提交的新型补体C5单克隆抗体Crovalimab(珂罗利单抗)的BLA已被美国食品和药物管理局(FDA)受理,用于突发性睡眠性血红蛋白尿(PNH)的治疗。如果获批,Crovalimab将成为首款每月只需用一次、患者可自我注射的治疗PNH的皮下制剂。
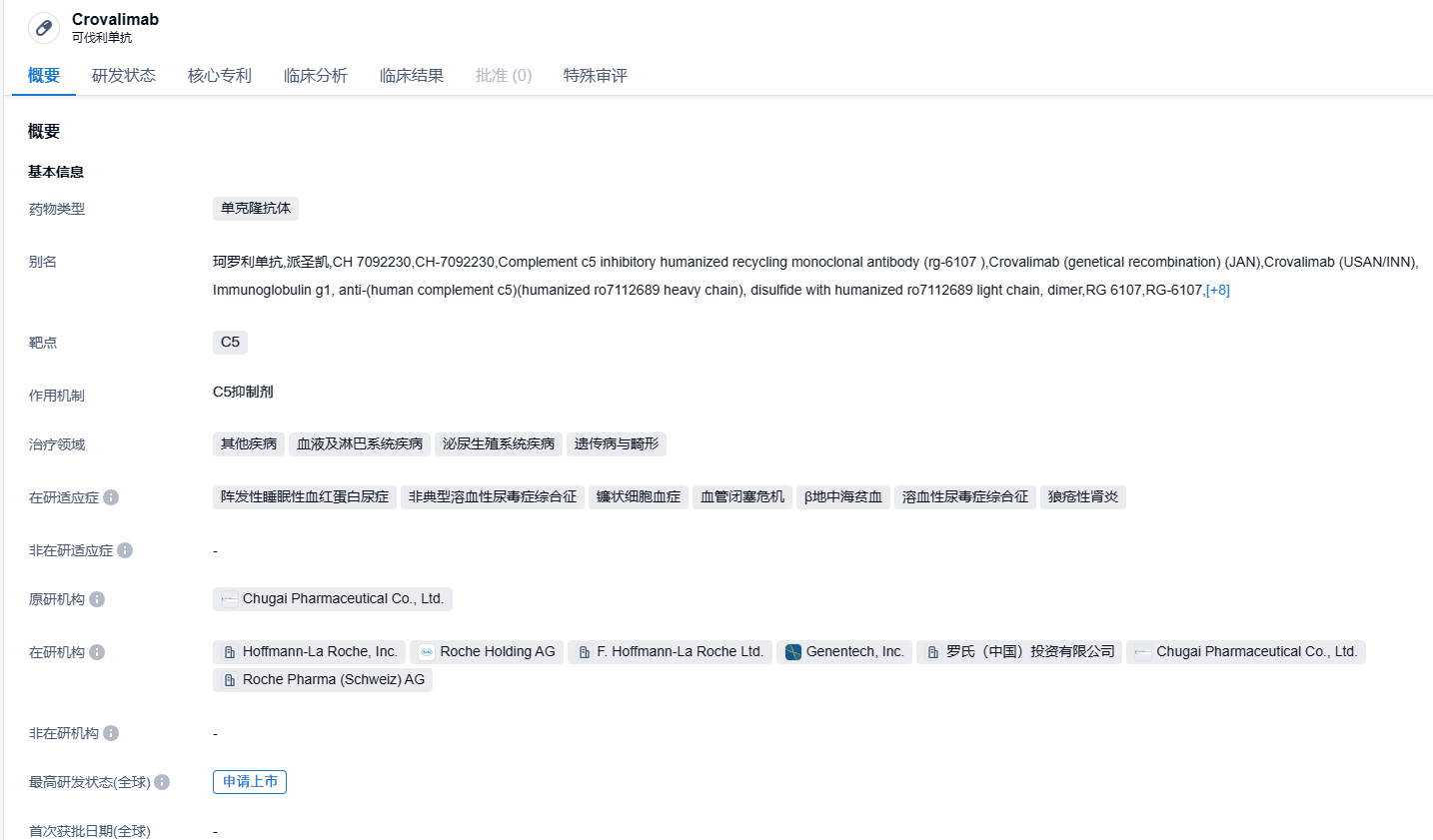
Crovalimab(珂罗利单抗)是罗氏研发的一种经过Smart-Ig单克隆抗体回收技术改造的新一代C5抑制剂,该药物能阻止补体C5裂解为C5a和C5b,可能有助于抑制补体活化。药物结合了等电点、新生儿Fc受体(FcRn)和pH依赖性亲和性技术,使其不只能与C5有效结合,提高内皮细胞对与C5结合的crovalimab的吸收,也能提高新生儿Fc受体介导的crovalimab的高效循环。2022年8月,珂罗利单抗注射液在国内的上市申请被受理,并且被列入优先审批品种,预期用于治疗PNH。目前,Crovalimab还在开发阶段,被用于非典型溶血性尿毒症(aHUS)、镰状细胞病以及其他补体介导的疾病的治疗。
 (文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
这次申请建立在两项III期研究(COMMODORE 1和COMMODORE 2)的积极结果上。COMMODORE 1是一个多中心、随机、开放标签、阳性对照的III期临床研究,对珂罗利单抗替代依库珠单抗或ravulizumab治疗的安全性进行了评估。COMMODORE 2是一项类似的临床试验,研究了珂罗利单抗(每4周一次,皮下注射)与依库珠单抗(每2周一次,静脉注射)比较在未接受过补体抑制剂治疗的PNH患者中的效果和安全性。结果表明,在COMMODORE 1的研究中,从接受依库珠单抗或ravulizumab治疗转为接受珂罗利单抗治疗后,患者的效果有所提升,风险较低;在COMMODORE 2的研究中,珂罗利单抗的效果优于依库珠单抗。
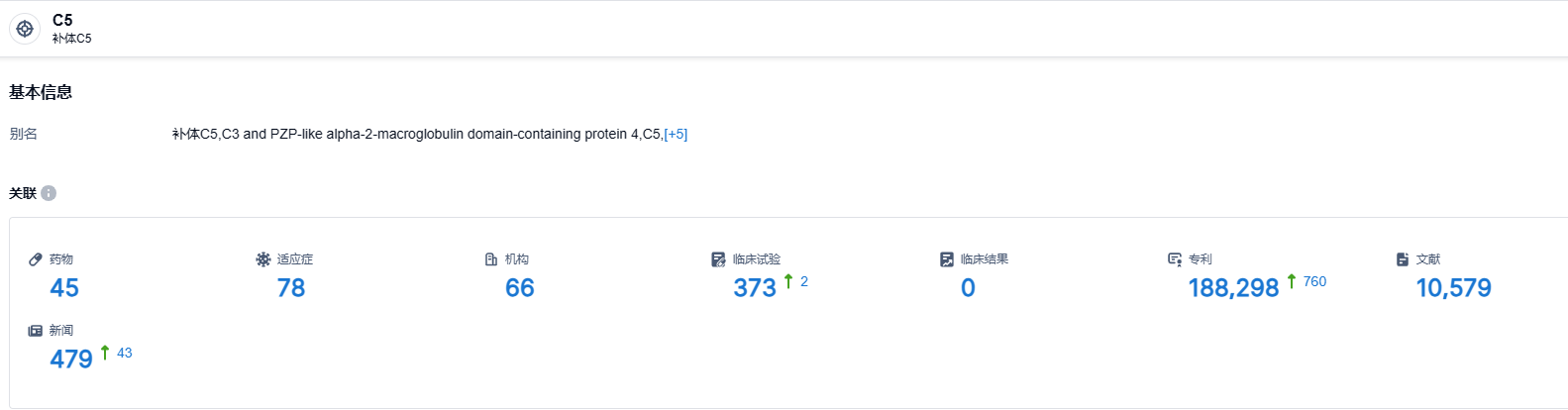
根据智慧芽新药情报库所披露的信息,截止到2023年9月7日,C5靶点研究中的药物共有45种,适应症78种,研发机构达66家,关联的临床试验有373项,专利高达188298项。补体蛋白C5已经是一个成功的补体药物靶点,首款药物Soliris(依库珠单抗)在2020年的销售额达到了40.64亿美元,2022年的销售额为37.62亿美元。Crovalimab作为每月只需使用一次,患者能自行注射的皮下制剂,大大简化了用药流程,具备成为一款重量级的潜在药物的可能。