在2023年的9月6日,森朗生物发布新闻稿称,已经收到美国FDA孤儿药开发办公室(OOPD)发出的官方书面答复,确认其研发中针对CD7的CAR-T细胞产品(SENL101自体T细胞注射液)获得孤儿药资格,用作治疗在成人复发或难于治疗的T淋巴母细胞淋巴瘤/白血病(T-LBL/ALL)。
SENL101自体T细胞注射液(又名SENL101)是森朗生物具有完全自主知识产权,是专门针对CD7阳性T细胞来源的血液淋巴系恶性疾病研发的CAR-T产品。早期临床研究已经证明,Anti-CD7 CAR-T在处理CD7阳性T淋巴细胞白血病/淋巴瘤肿的耐受性和安全性良好,有很大的治疗潜力。在过去的时间里,该产品已经在早期临床研究中验证了其治疗T-LBL/ALL的效果和安全性,并在2023年6月在中国得以批准临床,并在BLOOD杂志和美国血液学会(ASH)年会上进行了展示。
 (文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
在ASH年会的报告中,截止到2022年7月15日,中位随访时间为206(45-574)天。在第28天,95.8%(46/48)患者的骨髓/外周血(BM/PB)达到最小残留病灶(MRD)阴性的完全缓解(CR)。5名研究参与者在入组时并未出现BM母细胞的T-LBL,都维持为MRD阴性。在24名EMD(髓外病变)患者中,有20名患者在治疗后的第33天(中位数)出现缓解(13名CR和7名PR)。53名患者的18个月的总存活率(OS)和无事件生存(EFS)率分别为75.0%和53.1%。治疗后,32名患者在后续的3个月内选择进行Allo-HSCT(清髓性同胞异基因造血干细胞移植)以强化治疗,18个月的OS和EFS分别为75.8%和71.5%。
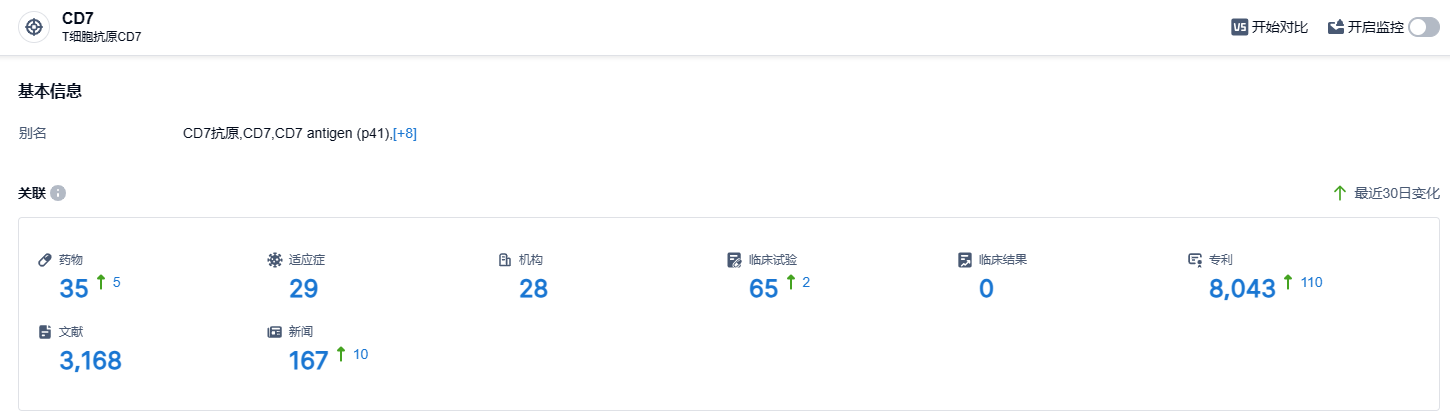
根据智慧芽新药情报库所披露的信息,至2023年9月7日,CD7靶点总计有在研药品35个,包含的适应症为29种,研发机构总计28家,涉及的临床试验数量大于65件,专利数有进步超过8043件……SENL101是森朗生物第二个投入商业化的产品。在此之前,森朗生物已有一款“Senl_B19自体T细胞注射液”在2021年的7月受到NMPA的批准,开启临床试验。CD7分子是一种在血液系统恶性疾病的肿瘤细胞表面的异常标志物,它在复发/难治性T-ALL/LBL中过表达。所以,一个针对CD7的CAR-T疗法能够为这类患者带来新的治疗选择,我们期待SENL101在未来能有更好的表现。