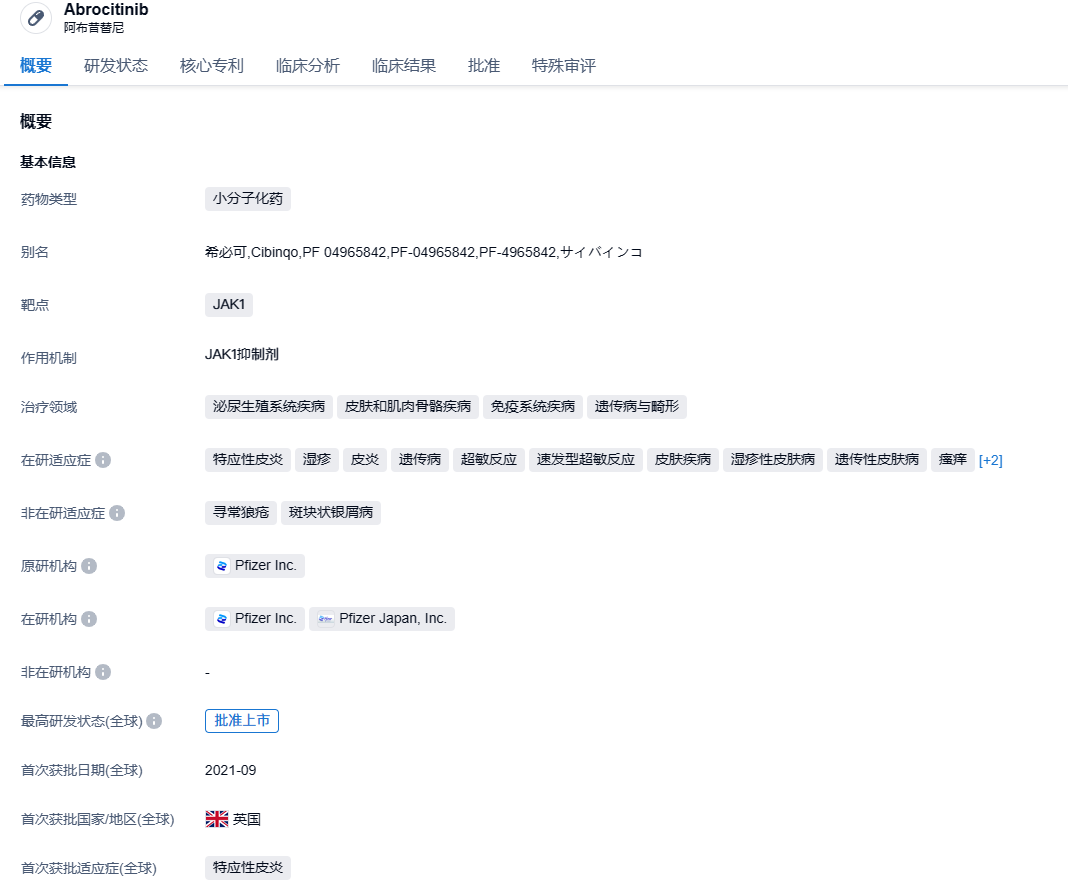
2023年9月19日,国家药品监督管理局药品审评中心在官方网站上公布,辉瑞的JAK1型口服抑制剂 “阿布昔替尼片”(abrocitinib)的上市申请已被列入优先审评。它主要适用于对其他治疗方式如激素或生物制剂应答不佳或无法接受上述疗法的难治性、中重度特应性皮炎患者,年龄在12岁及以上。
阿布昔替尼是一款针对Janus激酶1 (JAK1) 的口服小分子抑制剂,它通过阻断三磷酸腺苷(ATP)的结合位点可选择性和可逆性的抑制JAK1,调控包括IL-4、IL-13、IL-31、IL-22和胸腺基质淋巴细胞生成素等在内的一些AD和瘙痒发病机制相关的细胞因子信号传导,降低患者中性粒细胞减少和贫血的风险。阿布昔替尼的上市为中重度AD患者提供了全新的治疗选择。在2021年的9月,阿布昔替尼在英国首次获得上市批准,用于12岁以上的青少年和成年人,治疗中重度的特应性皮炎。在2022年1月14日,美国FDA批准辉瑞公司的 CIBINQO®(Abrocitinib,阿布昔替尼)用于治疗中重度特应性皮炎(AD)的成年患者。2022年4月11日,中国NMPA审批阿布昔替尼片在中国上市。
 (文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
药品审评中心公示,阿布昔替尼的上市申请已在优先审评名单中,主要适用于12岁及以上的中至重度特应性皮炎患者。阿布昔替尼在多次的临床研究中都已确认其对青少年特应性皮炎的治疗效果。包括在随机,双盲,安慰剂对照的3期JADE TEEN研究,以及随机,双盲,安慰剂对照的3期JADE MONO-1和JADE MONO-2的研究中,阿布昔替尼的效果都得到了肯定。在JADE TEEN研究中,阿布昔替尼的治疗效果和安全性在285名12至<18岁的中度到重度特应性皮炎青少年患者中得到了评估。
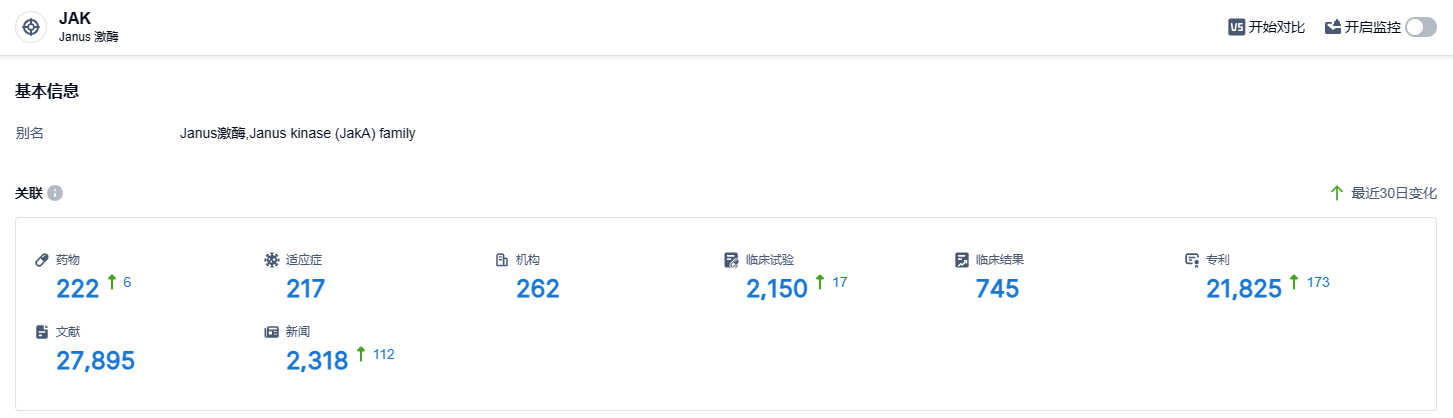
根据智慧芽新药情报库所披露的信息,截止到2023年9月21日,JAK靶点在研药物总计有222个,包含了217种适用病症,有262家研发机构参与,涉及2150项临床试验,已取得21,825项专利。JAK抑制剂市场在2022年已达到近百亿美元的规模,其中一代泛JAK抑制剂仍占有主导地位,二代JAK抑制剂如艾伯维公司主导的乌帕替尼正在逐步侵蚀一代JAK抑制剂的市场份额。阿布昔替尼作为一款二代JAK抑制剂,有望在新一波的市场竞争中崭露头角。