2023年9月25日,璧辰医药有限公司公布其药物ABM-1310得到美国FDA的快速通道资格,用以治疗携带BRAF V600E突变的胶质母细胞瘤(GBM)。FDA的这个快速通道认定,是对那些有潜力治疗严重疾病或者满足医疗需求的新药研发而授予在研药物的一种资格认定,获得该认定可以加快对这些药物的审评,这样可以让患者尽早获得新药。
ABM-1310是璧辰医药公司第一个自主开发的药物候选,它通过口服,高度选择性,高水溶性和高血脑屏障渗透性,显示出相当良好的功能。在动物模型的临床前期研究,ABM-1310已经表现出强大的血脑屏障渗透性。ABM-1310在2019年11月收到了FDA的临床试验许可,现在已在美国进行一期的临床实验,美国临床试验的登记号为:NCT04190628。而在2022年10月16日,中国已经有第一名患者成功使用这款药品,ABM-1310在中国开展的多中心、开放性、 剂量递增和扩展的一期临床研究,专门为了观察ABM-1310在BRAF V600X 突变晚期实体瘤患者对药物的安全性、耐受性以及药代动力学和初步的抗癌活性,以确保在进行二期临床研究时能够确定最佳的药物剂量以及临床初步疗效。在2023年8月2日,美国FDA授予 ABM-1310 孤儿药资格,用于治疗BRAF V600突变的脑胶质母细胞瘤(GBM)。
ABM-1310已经在美国和中国多个临床中心进行了针对BRAF V600突变晚期实体肿瘤的临床1期试验。在美国临床肿瘤学会(ASCO)2023年会上,已经公开了该试验的阶段结果。这个临床研究结果显示,ABM-1310在治疗晚期实体肿瘤(包括原发性脑肿瘤,比如GBM和其他的脑胶质瘤等)患者中,其抗癌效果显著且具有良好的安全性和耐受性。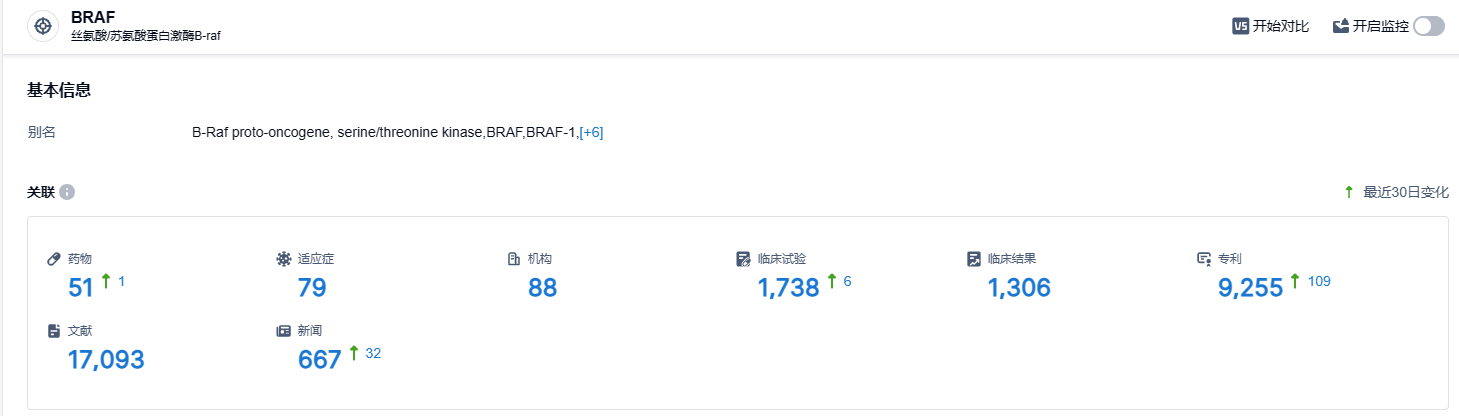
根据智慧芽新药情报库所披露的信息,截至2023年9月26日,BRAF 靶点总计有51种在研药物,涵盖79种不同的适应症,88个在研机构,有关的临床试验共1738项,且专利数量多达9255项,我们将密切关注ABM-1310在中美临床试验中的进一步表现。











