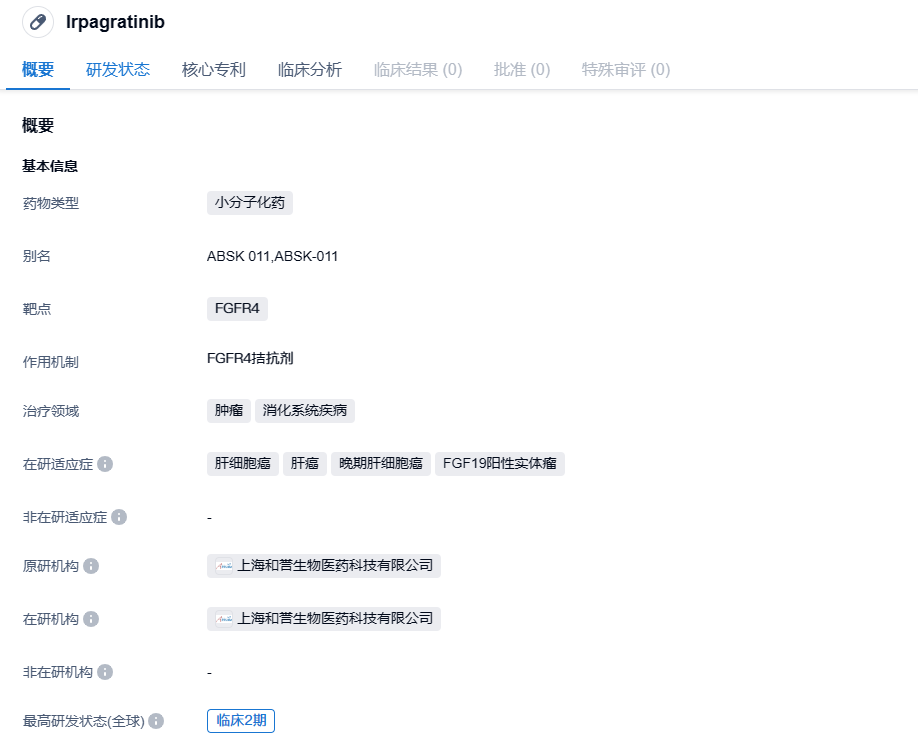
最近,和誉医药披露了其自研的高选择性小分子成纤维细胞生长因子受体4(FGFR4)抑制剂irpagratinib(ABSK011)有所突破:1)irpagratinib已得到美国FDA批准,可以在晚期肝细胞癌(HCC)病人中开展单药1期临床试验,也是和誉医药在中国之外开展irpagratinib首个临床试验;2)利用irpagratinib与仑伐替尼联合治疗晚期或无法切除的HCC的二期临床试验申请(IND)得到中国国家药监局(NMPA)批准。
Irpagratinib 是一款高选择性的 FGFR4 小分子抑制剂,旨在治疗晚期实体肿瘤,特别是具有 FGFR4 信号通路异常的晚期 HCC、胆管癌、乳腺癌等(如配体FGF19扩增/过表达,FGFR4突变/扩增/融合等)。FGFR4 信号通路是开发 HCC 分子靶向治疗的重要候选方向。对比竞争性产品,Irpagratinib 所展示的效果和抗肿瘤活性更好,在临床前研究中显示良好的物理化学性质。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
最新得到批准的研究为“一个开放的评价 ABSK-011 在晚期实体瘤患者中安全性、耐受性及药体动力学的 I 期临床研究”。研究对象主要为 FGF19 过表达的 HCC 患者。这是和誉医药在中国以外进行的第一个 Irpagratinib 临床试验。2022年12月,和誉医药发布了Irpagratinib在中国进行的针对FGF19过表达II线HCC患者的1期初步结果,表现出优秀的安全性和效果。和誉医药还计划在2023年欧洲肿瘤学会(ESMO)年会上发布在上述I期临床试验中的最新结果。同时,和誉医药在中国大陆正在对FGF19过表达的晚期HCC患者进行利用irpagratinib联合抗PD-L1抗体阿替利珠单抗(由罗氏制药开发)的二期试验,该试验已在2022年2月完成首例患者入组。
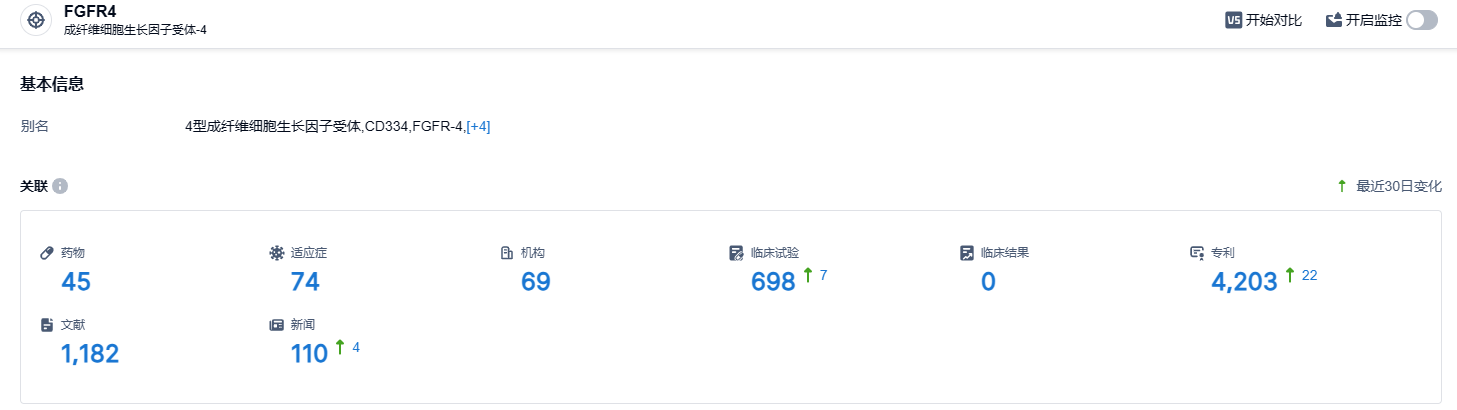
根据智慧芽新药情报库所披露的信息,至 2023 年9月27日,FGFR4 靶点共有在研药物45个,包含74种适应症,69个研发机构,涉及共698项临床试验,而专利多达4203个。弗若斯特沙利文预测,中国以及全球FGFR4药品市场在2025-2030年的复合年增长率分别为50.9%和60.1%,预计2026年中国和全球的FGFR4药品市场将分别达到2.08亿美元和5.55亿美元,到2030年将分别达到7.40亿美元和24.35亿美元。期待Irpagratinib能在FGFR4靶向药物竞赛中胜出。