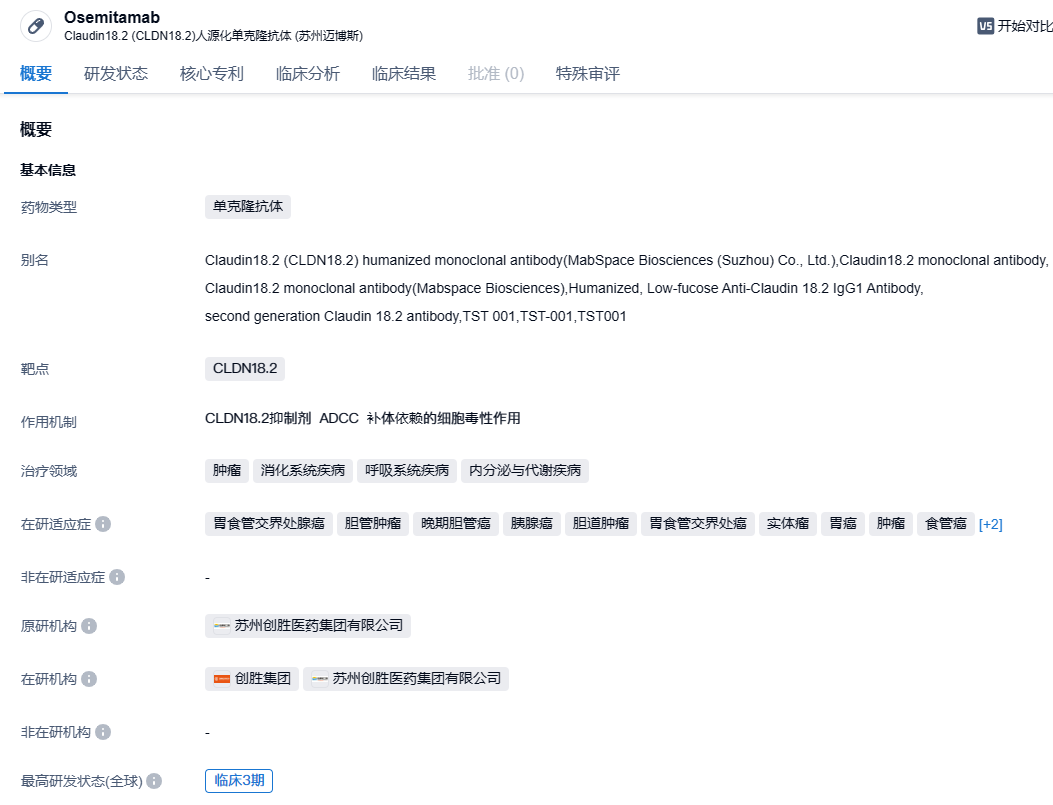
近日,创胜集团获得美国FDA批准,展开全球三期关键性实验TranStar 301,在HER2阴性、CLDN18.2表达局部晚期或转移性胃癌以及胃食管结合部腺癌(G/GEJ)患者中,检验抗CLDN18.2单抗Osemitamab(TST001)联合抗PD-1抗体纳武利尤单抗和化疗作为首次治疗方法的疗效与安全性。这项全球化的实验,已经得到中国国家药品监督管理局药品审评中心(CDE)以及韩国食品药品安全部(MFDS)的通过。
Osemitamab(TST001)是创胜集团研发的一种对Claudin18.2有高亲和力的人源化单克隆抗体,具有增强的抗体依赖性细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)活性,在异种移植试验中表现出了强大的抗癌活性。Osemitamab(TST001)通过ADCC和CDC机制消灭表达Claudin18.2的肿瘤细胞,借助先进的生物技术,Osemitamab(TST001)在制造过程中将岩藻糖含量极大地降低,从而进一步增强了Osemitamab(TST001)的NK细胞介导的ADCC活性。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
此前,创胜集团在2023年ASCO年度大会和2023年ESMO GI年度大会上公布了 Osemitamab(TST001)和CAPOX联合作为胃癌或胃食管结合部腺癌首选治疗方案的疗效数据。共有64名CLDN18.2阳性病人(定义为:使用LDT方法≥10%的肿瘤细胞的CLDN18.2 IHC膜染色强度≥1+,大约筛选出了55%的病人)接受了治疗,此中49名接受了6mg/kg的剂量疗法。数据显示,在所有剂量组别中,预计中位无进展生存期为9.5个月,与所有CLDN18.2表达水平一致,预计中位缓解持续时长为9.9个月。
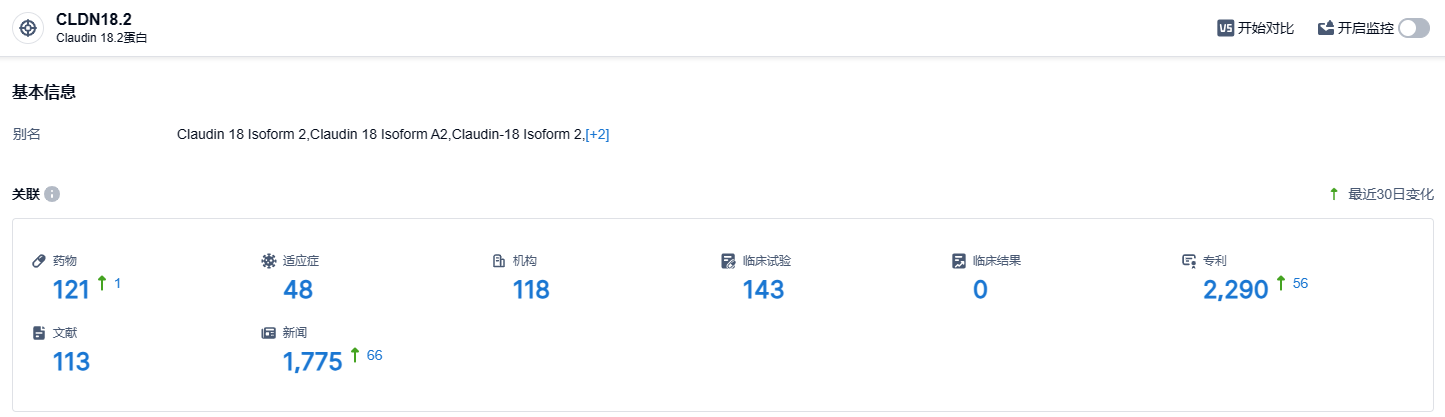
根据智慧芽新药情报库所披露的信息,截止到2023年10月8日,CLDN18.2靶点总共有在研药物121个,包含的适用病种有48项,正在研发的机构有118家,相关临床试验有143项,专利多达2290项……CLDN18.2靶点研发热度极高,国内外都有诸多药企参与,我们期待国产CLDN18.2靶点新药能够早日上市,同外企新药一起竞争。