近日,中国药物临床试验登记与信息公示平台的官方网站上显示,君实生物已经开展了一项国际多中心的3期临床试验(包含中国),目的是检查PD-1抑制剂特瑞普利单抗联合或不联合抗BTLA单抗tifcemalimab(JS004/TAB004)作为局部小细胞肺癌(LS-SCLC)在放疗后未进展病患巩固治疗的安全性和效果。今年6月,美国FDA已批准该联合疗法针对上述LS-SCLC适应症的3期试验。
Tifcemalimab(JS004/TAB004)是君实生物自主研发并全球首次进入临床开发阶段(first-in-human)的抗肿瘤的重组人源化抗BTLA(B和T淋巴细胞衰败因子)单克隆抗体。当前,tifcemalimab已经进入Ib/II期的临床试验,与特瑞普利单抗联合的多项临床研究正在中国和美国同时进行,涉及多种癌症。Tifcemalimab的靶点是在2003年发现的BTLA,它是CD28受体家族的一员。BTLA上的IgSF V细胞外区和其他CD28家族成员(如PD-1和CTLA-4)具有相似性。BTLA在T和B淋巴细胞及树突细胞亚群中都有表达。BTLA与其配体HVEM(Herpes virus entry mediator,疱疹病毒侵入介质)的相互作用于2005年被揭示,而HVEM是广泛在造血系统中表达的TNF受体,被确认是BLTA的配体。
 (文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
今年5月,君实生物的抗BTLA单抗tifcemalimab再一次在ASCO会议上亮相,首次公布了tifcemalimab联合特瑞普利单抗治疗广泛性小细胞肺癌(ES-SCLC)的I/II期研究数据。在38例疗效可评估的患者中,ORR为26.3%,DCR为57.9%。其中,接受过免疫治疗的患者ORR为8.3%,没有接受过免疫治疗的患者ORR达到40.0%。期待该药治疗LS-SCLC的相关临床试验结果数据公布。
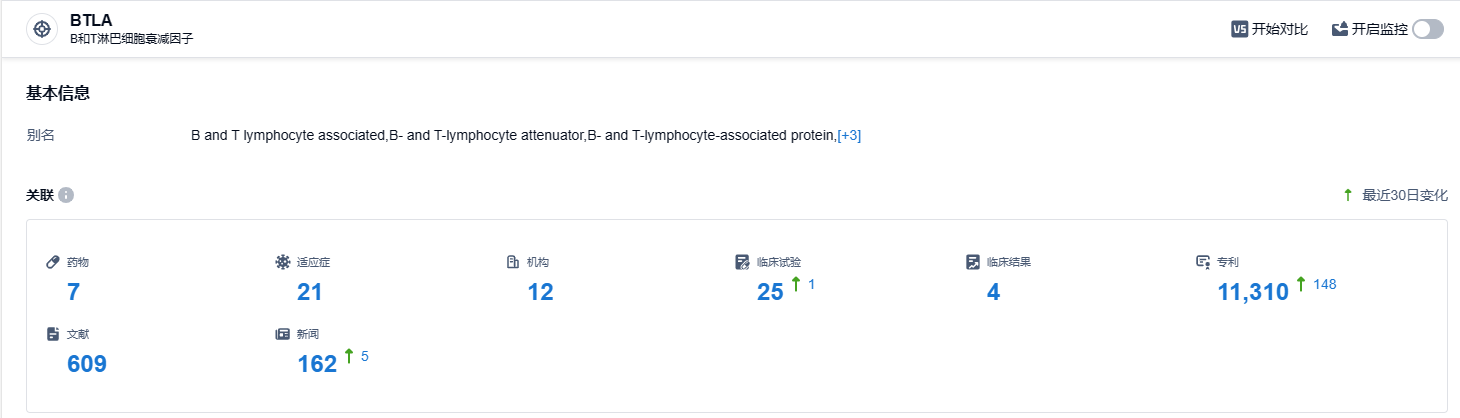
根据智慧芽新药情报库所披露的信息,至2023年10月17日,BTLA 靶点总共有正在研究中的药物7个,涵盖适应症有21种,在研机构有12家,进行的临床试验25项,专利达到了11310项……目前,研究BTLA靶点的公司不多,君实生物是领先者。期待tifcemalimab的研发顺利,能为广大癌症病患带来新的治疗方式。