艾伯维(AbbVie)最近宣布了risankizumab三期SEQUENCE研究的积极结果,该研究旨在评估白细胞介素-23(IL-23)抑制剂risankizumab(商标名:Skyrizi)与活性对照药物相比,在一种或多种抗肿瘤坏死因子(TNF)治疗失败的中度至重度活动性克罗恩病患者中的效果和安全性。
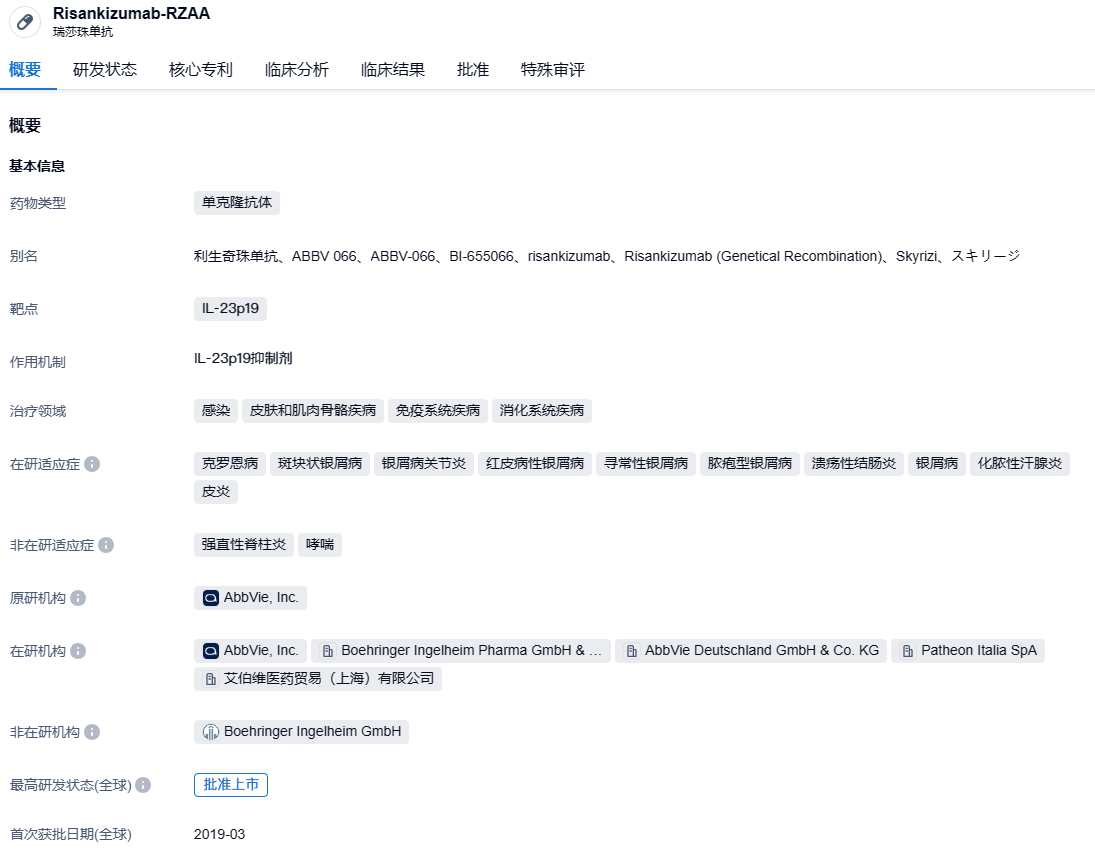
Risankizumab是一种白细胞介素-23(IL-23)抑制剂,它通过结合其p19亚基选择性地阻断IL-23,IL-23是一种细胞因子,参与炎症过程,被认为与许多慢性免疫介导的疾病相关。Risankizumab在2019年4月首次被批准,已经获得美国FDA和EMA批准,适用于治疗银屑病性关节炎和斑块状银屑病。Skyrizi在上市第一年销售额达到3.55亿美元,第二年的销售额达到15.9亿美元,到了2022年,全球销售总额已经达到了51.65亿美元。
 (文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
目前,正在进行关于risankizumab治疗银屑病、银屑病关节炎、克罗恩病和溃疡性结肠炎的三期试验。SEQUENCE研究设置了两个主要终点来依次进行测试:第一个主要终点第24周时的临床缓解(定义为克罗恩病活动指数[CDAI]总分<150),结果显示risankizumab与活性对照药物ustekinumab(商标名:Stelara)相比有非劣效性(预先设定的非劣效界值为10%);其中risankizumab组的缓解率为59%,而活性对照组为40%。此外,研究团队对这一终点数据进行了后期分析以验证其优越效果,并得到了P值小于0.01的显著结果。另一个主要的终点是48周时的内镜缓解(克罗恩病简易内镜评分(SES-CD)≤4分,与基线相比至少降低2分,且所有的单项分值都不超过1分),结果显示risankizumab的缓解率为32%,活性对照药为16%。
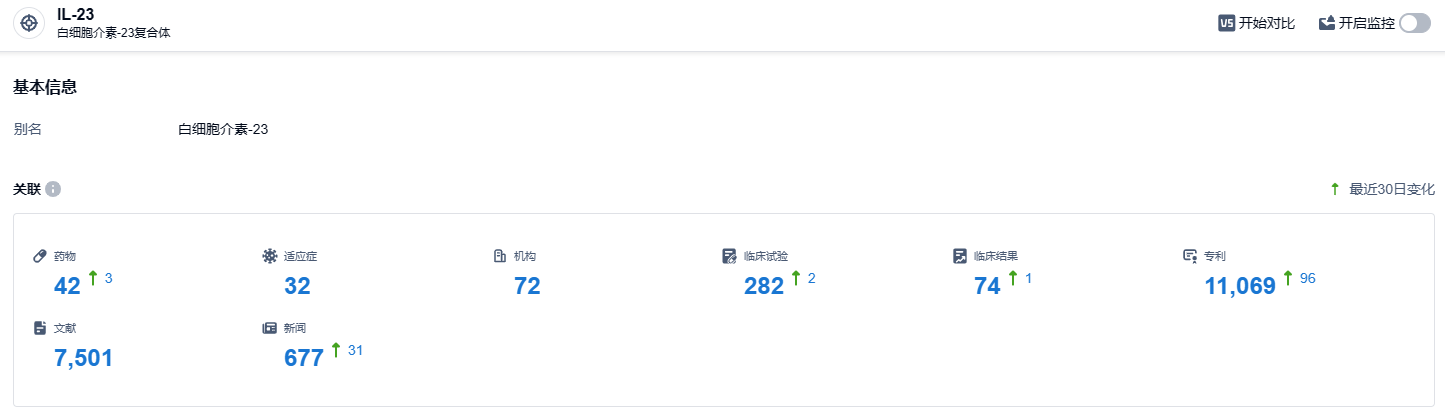
根据智慧芽新药情报库所披露的信息 ,截止到 2023 年10月19日,研究IL-23 靶点的药物共有42种,涉及的适应症有32种,参与研究的机构有72个,有关的临床试验有282起,专利总数高达11069个。自从2019年Risankizumab上市以来,销售一直保持迅速增长的趋势,全球三大药物市场,中国是唯一还未获批上市的地方,预计未来中国市场一旦开放,销售将会再创新纪录。