近日,SELLAS生命科学集团(SELLAS Life Sciences Group)公开了新型高选择性CDK9抑制剂SLS009(GFH009)与venetoclax(ven)和azacitidine(aza)联用治疗对venetoclax治疗无效或失效的复发或难治性急性髓性白血病(AML)患者的2a期临床试验的结果。
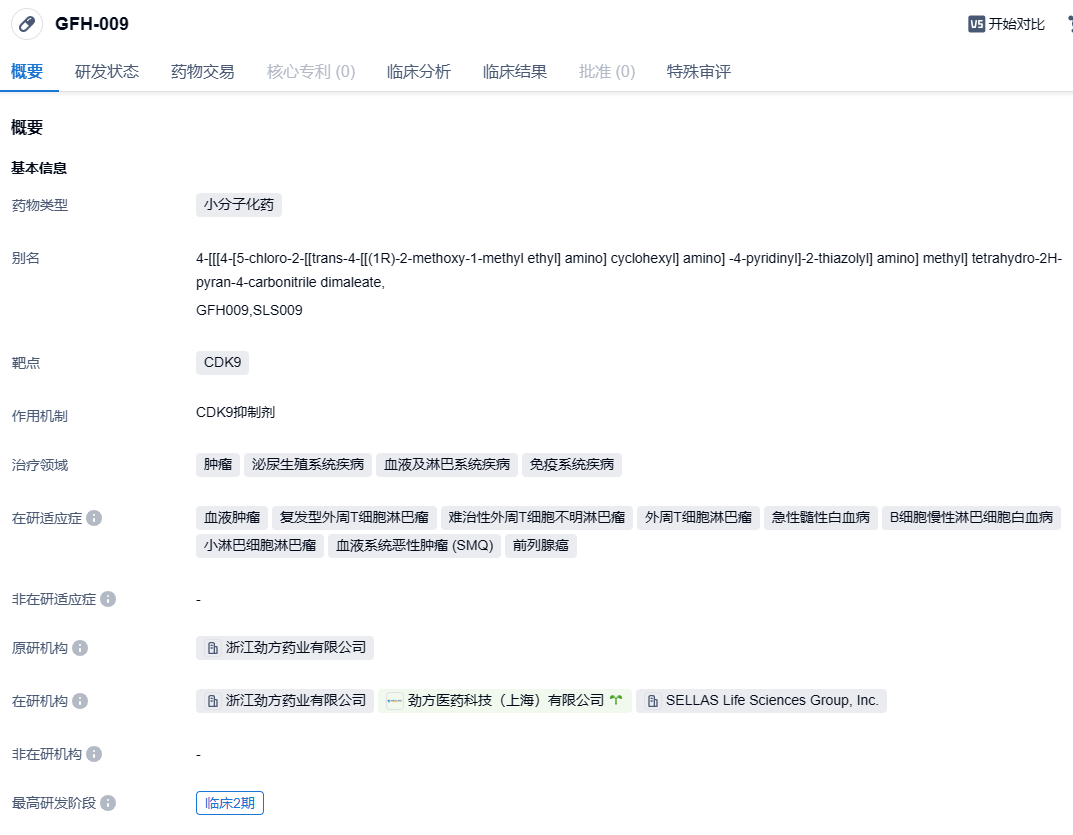
SLS009(GFH009)是劲方医药研发的一个高选择性的小分子CDK9抑制剂。其单药一期临床试验和临床前的实验数据都被选为2022 ASH壁报。单药临床试验显示,GFH009具有良好的安全性,并在多种血液肿瘤患者中显示出积极的疗效,包括一例急性髓性白血病患者观察到完全缓解并持续超过8个月。临床前实验数据也显示,GFH009通过特异性抑制CDK9蛋白,可以降低原癌基因的表达,抑制癌细胞的快速分裂和蛋白质合成,并诱发细胞衰老和癌细胞死亡。此外,GFH009对其他CDK亚型的选择性超过100倍。在体外和体内的药效实验中,GFH009可以明显抑制多种血液肿瘤细胞系的增殖,降低荷瘤动物的死亡率,并显著延长模型动物的存活时间。2022年4月,SELLAS生命科学集团与劲方医药达成了全球开发和商业化的独家授权协议,SELLAS获得了SLS009在大中华区以外的全部权益。SLS009近期还获得了美国FDA的孤儿药物资格,用于治疗AML。
 (文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
此项试验是一个开放标签、单臂、多中心的2a期临床试验,目标是评估45 mg和60 mg两种剂量的SLS009与aza/ven联用的安全性、耐受性和效果。在研究诸多方面之外,主要终点是复合CR和缓解持续时间(DOR)。其他终点包括无事件生存期(EFS)、总生存期(OS)、药代动力学(PK)和药效学评估(PD)。维奈托克治疗失败的AML患者的治疗选择有限,预后较差,中位OS约为2.5个月。到目前为止,已有5名接受维奈托克治疗失败的AML患者加入了45 mg SLS009剂量组。第一名加入研究的患者获得了CR,现在仍在接受第五个月的治疗;第二名加入研究的患者也仍然存活,目前正在接受第四个月的治疗。所有加入研究的患者在最后一次随访时均存活,其中4名患者仍在继续治疗。在所有患者身上都观察到了该联合疗法的抗白血病效果,没有出现任何明显的安全性问题。
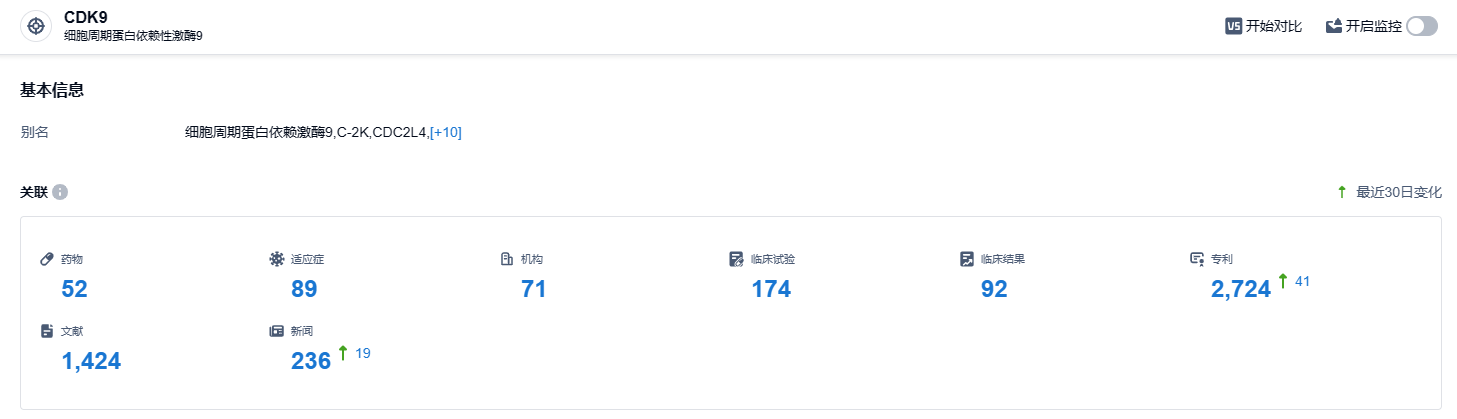
根据智慧芽新药情报库所披露的信息,截至2023年10月19日,CDK9靶点共有52种在研药物,涉及89种适应症,且有71家在研机构,有174项相关的临床试验,并有2724项专利。细胞周期依赖蛋白激酶(cyclin-dependent kinase, CDK)是一类丝氨酸/苏氨酸激酶家族蛋白,在细胞周期调节和转录过程中发挥重要作用;CDK9的活性与多种血液肿瘤和实体瘤患者的总生存率呈现负相关。我们期待CDK9抑制剂GFH009的开发能够顺利,为患者带来新的治疗选择。