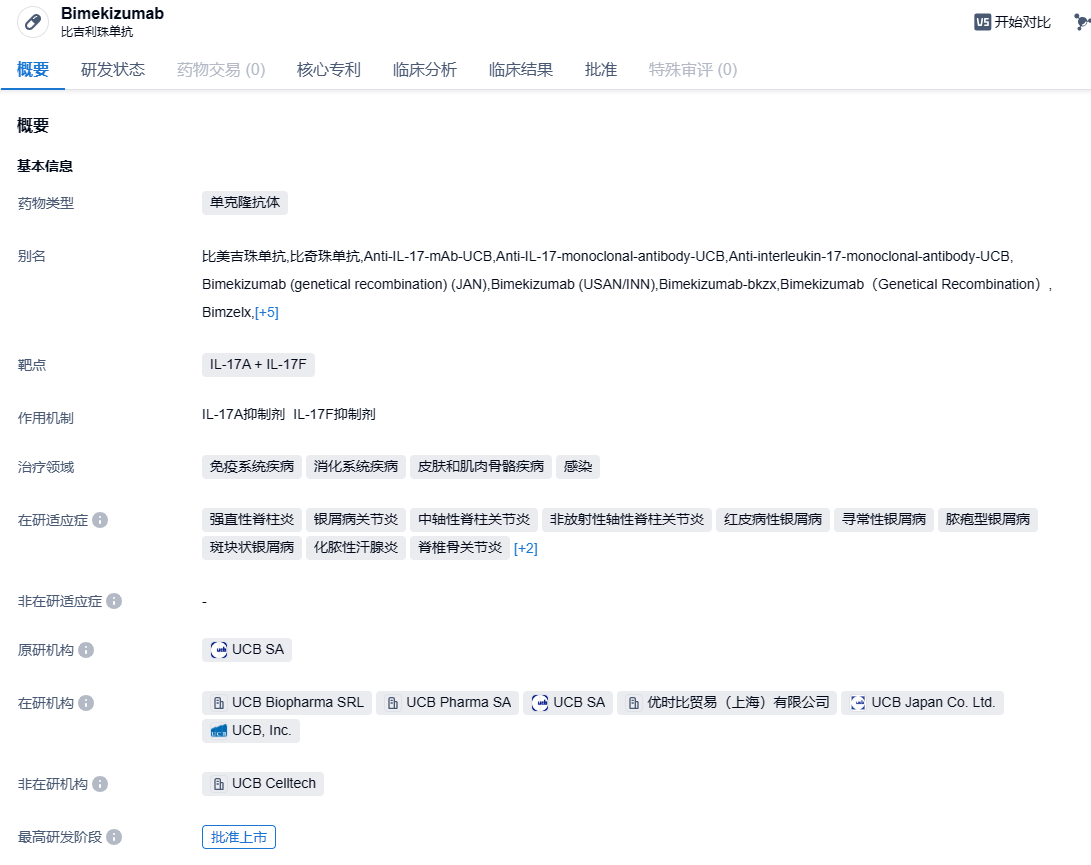
2023年10月19日,优时比(UCB)公告,Bimzelx(bimekizumab)已经获得美国FDA的批准,可以用于治疗适合接受全身治疗或光疗的中重度斑块状银屑病的成年病人。Bimekizumab是全世界首款被批准用于治疗中重度斑块状银屑病的白介素-17 A/F(IL-17A/F)的抑制剂。
Bimekizumab是一种人源化单克隆IgG1抗体,旨在同时阻止白细胞介素 17A(IL-17A)和白细胞介素17F(IL-17F),这两种都是推动炎症过程的关键细胞因子。这种独特的作用方式比起其他的IL-17A类药物可能有更优秀的治疗效果。此外在2021年8月,Bimekizumab在欧盟和英国被批准用于适合系统治疗的成人中重度斑块状银屑病,2022年1月在日本被批准,用来治疗对目前的治疗方式响应不足的斑块状银屑病、泛发性脓疱型银屑病、和红皮病型银屑病患者。在2022年的2月和3月,又在加拿大和澳大利亚获得了批准。这次在美国又得到了批准,Bimekizumab有可能为更多的患者提供新的治疗选择。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
在三项三期研究中评估了Bimekizumab与安慰剂和IL-12/IL-23抑制剂ustekinumab(BE VIVID试验)、与安慰剂(BE READY试验)和与TNFα抗体adalimumab(BE SURE试验)的疗效和安全性的比较。所有研究都达到了其共同主要和次要终点。相比于接受活性对照组(次要终点,BE VIVID;p<0.0001)、安慰剂(共同主要终点,BE READY和BE VIVID;p<0.0001)和adalimumab(共同主要终点,BE SURE;p<0.001)治疗的病人,接受Bimekizumab治疗的病人在第16周获得了更高的皮损清除率,也就是在PASI 90(银屑病面积与严重程度指数改善达90%)和研究者总体评估(IGA)分数为0(银屑病症状清除)或1(几乎清除)有显著的改善。
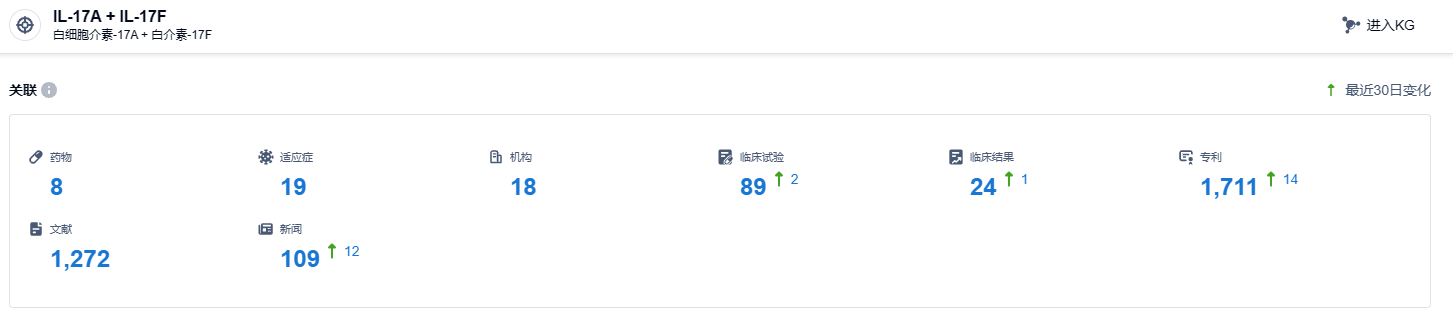
根据智慧芽新药情报库所披露的信息,截至2023年10月20日,针对IL-17A/F靶点的在研药物共有8种,与19种病症有关,18个在研机构参与,相关的临床实验达到89个,专利应用高达1711个。而在2023年4月26日,比吉利珠单抗注射液(bimekizumab)在我国提出了上市申请,期待早日得到批准,为中国的患者带来新的治疗选择。