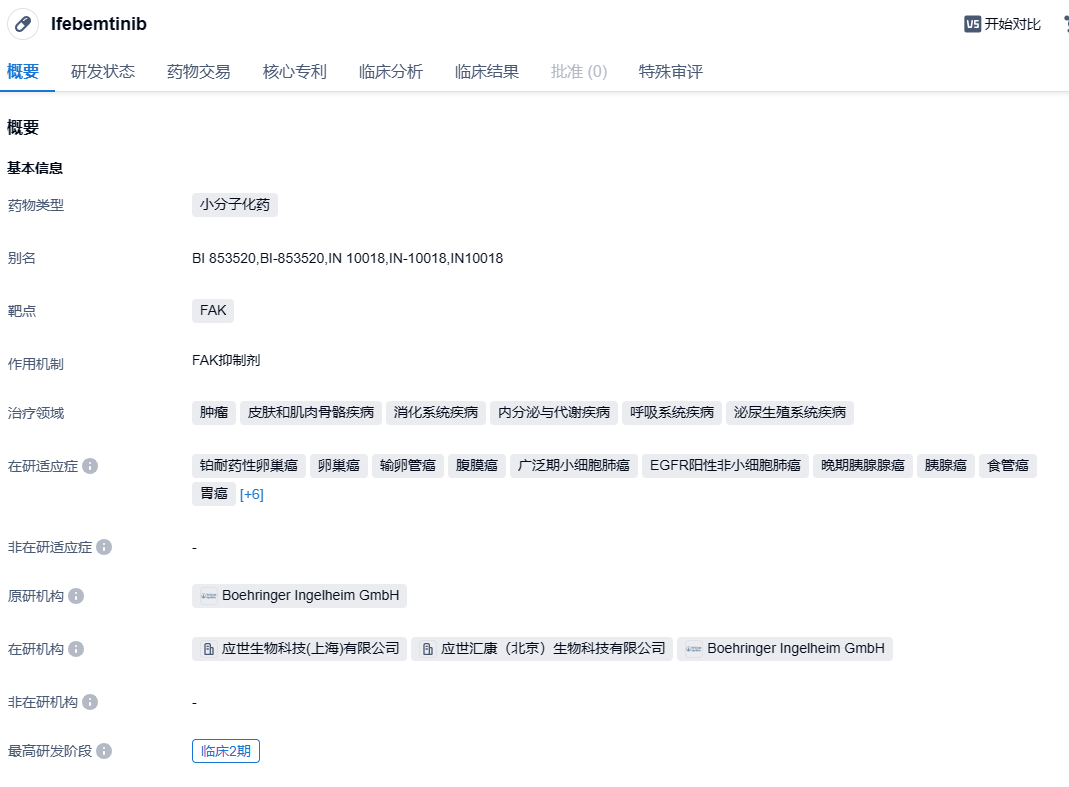
2023年10月23日,世应生物宣布,该公司研发的核心创新产品—小分子FAK抑制剂Ifebemtinib(IN10018)的两个关键临床研究结果,已于2023年10月20日至24日在西班牙马德里举办的2023年欧洲肿瘤学会年会(ESMO 2023)以壁报的方式公布。研究数据表明,以IN10018为核心的不同联合治疗方案,在铂耐药复发卵巢癌患者和三阴乳腺癌患者的两个临床试验中,展示出十分有前景的抗肿瘤效果,并且展现出显著生存期获益趋势。
Ifebemtinib(IN10018)是世应生物开发的一种高效且高选择性的FAK抑制剂。IN10018的早期临床数据显示其安全性良好且在多种癌症上具有疗效。最新的研究结果指出,IN10018有望通过克服肿瘤基质纤维化屏障和调整肿瘤免疫抑制的微环境,破坏肿瘤的防御机制,有效克服耐药和转移,成为多种治疗方案的基石分子。IN10018正处于各种临床开发阶段,包括铂耐药复发卵巢癌、三阴性乳腺癌、非小细胞肺癌、小细胞肺癌、胰腺癌以及KRASG12C突变肿瘤等多个适应症。前期的临床研究结果已先后被ASCO、CSCO、SMR、ESMO等国际和国内重要肿瘤学术会议接纳和展示,并获得美国FDA的快速通道认证(Fast-track Designation)和中国药监局的突破性治疗资质。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
由中国医学科学院肿瘤医院吴令英教授领导开展的关于IN10018联合聚乙二醇脂质体多柔比星(PLD)治疗铂耐药复发卵巢癌的Ib期临床研究。研究主要终点是客观缓解率(ORR),次要终点是总体疾病控制率(DCR)、缓解持续时间(DOR)、无进展生存期(PFS)和总生存期(OS)等。铂耐药卵巢癌的治疗手段十分有限,PLD是常选的标准化疗方案之一。过去的研究数据显示,PLD单药治疗的ORR约为10 % ,PFS约3.3个月,OS约12个月。在这项研究中,IN10018联合PLD展示出显著的抗肿瘤效果,在中位PFS和中位OS两个生存期指标都展现出显著获益趋势。
复旦大学附属肿瘤医院胡夕春教授领导开展的关于IN10018联合PLD和特瑞普利单抗治疗晚期三阴性乳腺癌的Ib/II期临床实验研究,目的是评估IN10018两药和三药组合在接受过1至2线标准治疗失败、无法手术治疗的局部晚期或转移性三阴乳腺癌患者中的抗肿瘤效果、安全性和耐药性。这是首次公开的关于IN10018在该适应症的临床研究结果。
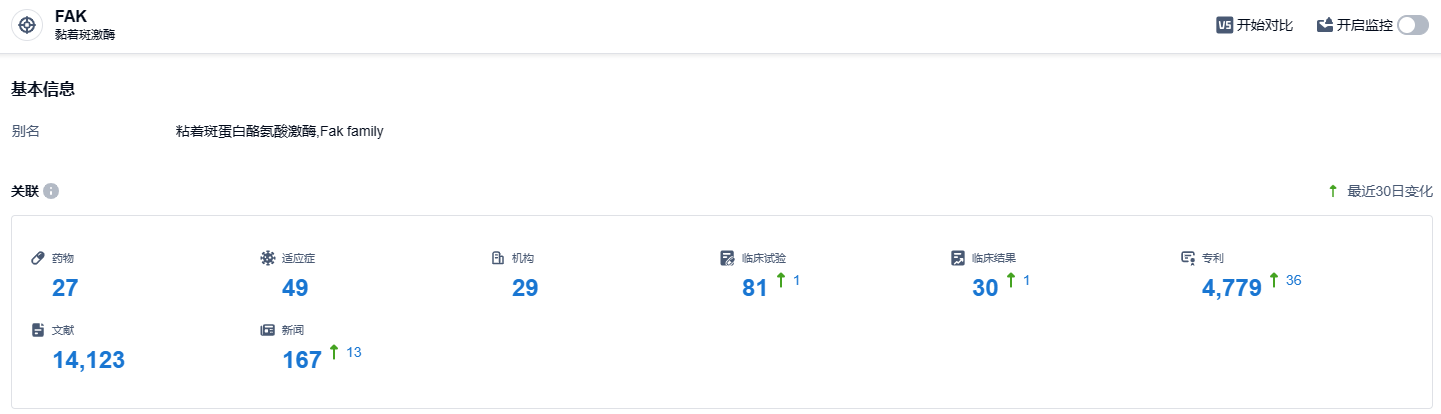
根据智慧芽新药情报库所披露的信息,截止到2023年10月24日,FAK靶点共涉及的在研药品有27种,包括的病症有49种,涉及的研究机构有29个,相关临床试验81项,专利数量高达4779项…… 世应生物拥有IN10018的全球独家开发和商业运营权。鉴于前期的优异的临床数据,IN10018已先后获得美国FDA快速通道认证(Fast-track Designation)和中国药监局突破性治疗资质,目前进展最快的注册临床正在进行,预计2024年将提交新药上市(NDA)申请。期待IN10018能够研发顺利。