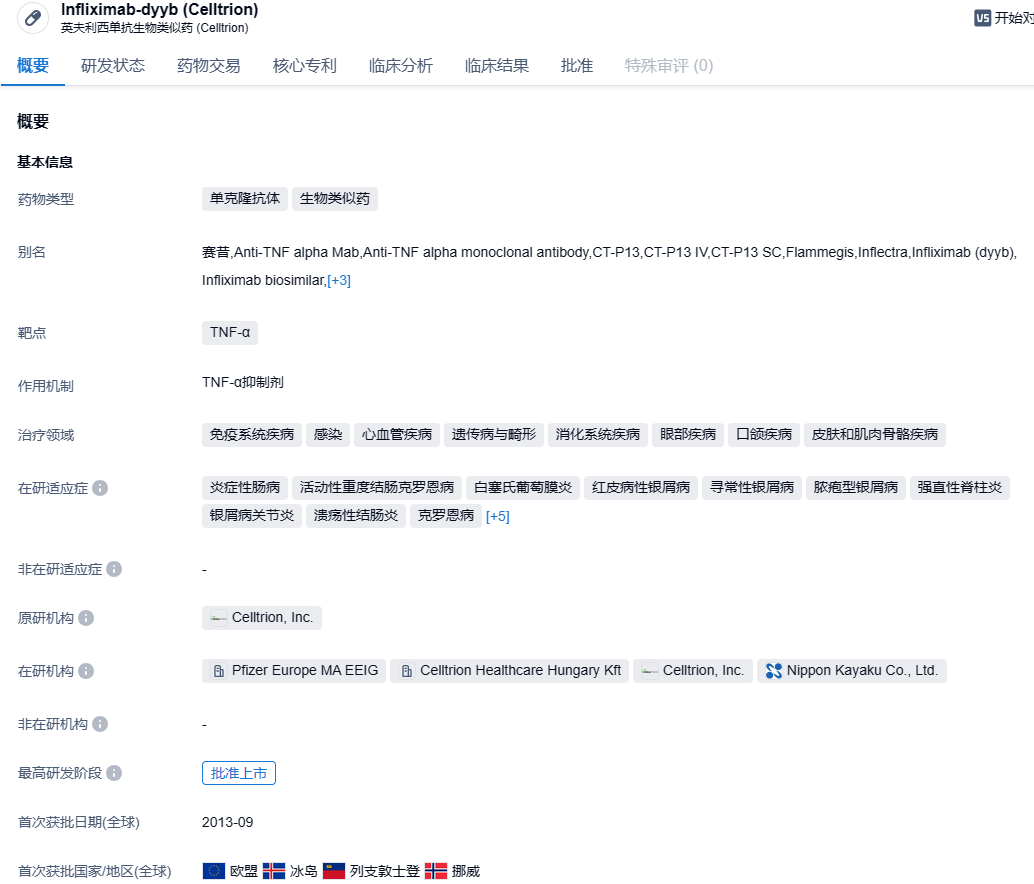
2023年10月25日,Celltrion公司公布消息,美国食品和药物监督管理局(FDA)已经授权Zymfentra(infliximab,英夫利西单抗)用于中重度活动性溃疡性结肠炎(UC)以及克罗恩病(CD)患者在接收静脉注入infliximab治疗后的维持治疗。根据发布的新闻通告,Zymfentra是第一个由FDA批准作为炎症性肠病(IBD)治疗的infliximab皮下制剂。
英夫利西单抗(原研药商品名:Remsima)的原研企业为强生,是一种抗肿瘤坏死因子(TNF-a)单克隆抗体,用于治疗CD、UC、类风湿性关节炎以及强直性脊柱炎等患者。而Zymfentra则是Celltrion公司研发的首个抗体生物类似药,目前已获得核准应用于常规治疗无效的中度、重度IBD,是四种主流治疗IBD生物药剂之一。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
Zymfentra的皮下制剂提供了在血清中稳定升高的infliximab单抗水平。FDA对Zymfentra的上市批准主要基于第三期关键数据,这些数据对Zymfentra作为中度和重度活动性UC(LIBERTY-UC)以及CD(LIBERTY-CD)患者维持治疗的疗效和安全性进行评估。根据LIBERTY UC和LIBERTY CD研究的结果,在UC和CD患者接受infliximab单抗静脉制剂诱导治疗后,为期54周的研究表明,与安慰剂相比,Zymfentra在主要终点临床缓解(UC和CD)以及内镜下缓解(CD)方面表现优良。在两项研究中,维持期Zymfentra的总体安全性特征与安慰剂相似,未观察到新的安全性信号。
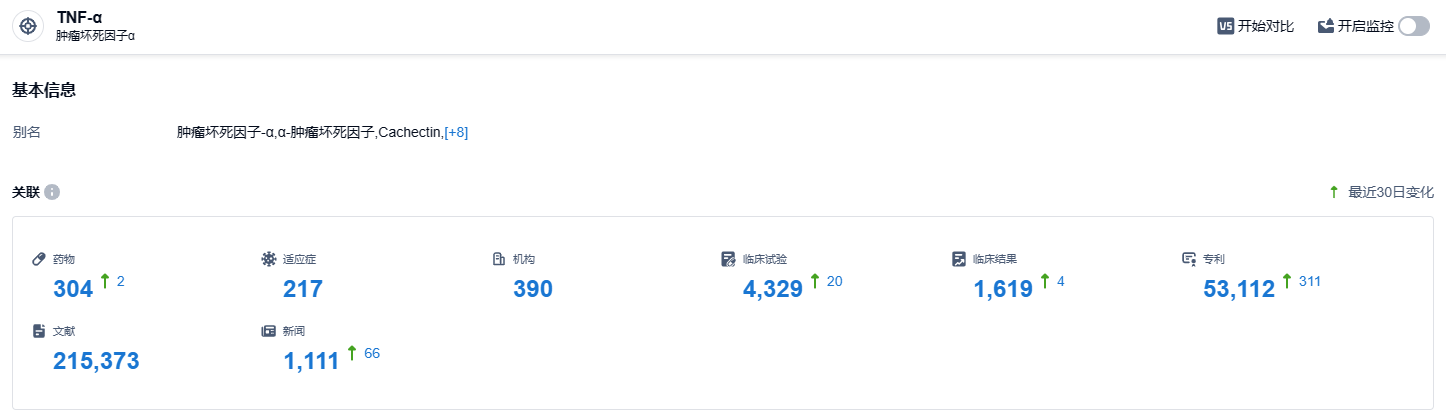
根据智慧芽新药情报库所披露的信息,至2023年10月26日为止,TNF-a靶点的在研药物共有304种,覆盖的适应症有217种,研究机构达到390家,相关的临床试验有4329项,专利数量多达53112件…Zymfentra皮下制剂改善了原来静脉注射的短板,使患者可以自行注射,减少去医院的频率,提高了患者用药的便利性。同时,新剂型也为医生提供了另一种替代性的给药选择,克服了TNF-α抑制剂的局限性。希望更多的患者可以从中受益.