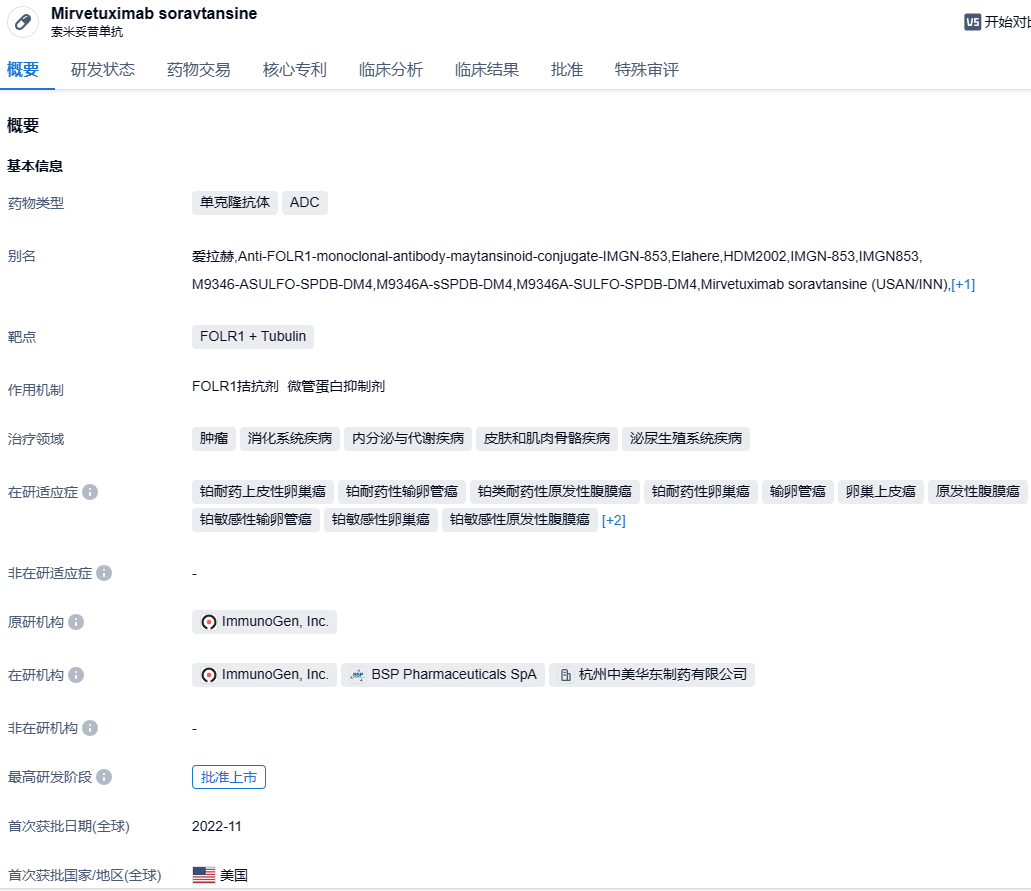
2023年10月25日,华东医药宣告,其全资子公司中美华东收到中国国家药品监督管理局(NMPA)签发的《受理通知书》。由中美华东与ImmunoGen公司联合研发的索米妥昔单抗注射液(mirvetuximab soravtansine Injection,研发代码:IMGN853、HDM2002)的上市许可申请获得受理,适用于:过去接受过1-3线系统性治疗的叶酸受体α(FRα)阳性铂类耐药上皮性卵巢癌、输卵管癌或原发性腹膜癌的患者。
索米妥昔单抗(HDM2002/ MIRV/ELAHERE®)是华东医药与ImmunoGen携手研制的第一款针对叶酸受体 α 阳性卵巢癌 ADC 药物,该产品已在 2022年11月在美国FDA获得加速审批上市,用于治疗叶酸受体 α(FRα)阳性且有1-3 线全身治疗方案的铂耐药卵巢上皮性癌、输卵管癌或原发性腹膜癌患者群体。2020年10月,华东医药与ImmunoGen达成协议,以初始付款4000万美元和最多达2.65亿美元的里程碑付款以及约定比例的销售额提成费获得索米妥昔单抗在中国的开发与商业化权益,同时ImmunoGen则保留该药品在中国以外地区的全部权利。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
该项研究共计入选了106名铂类耐药性高级别浆液性上皮性卵巢癌、原发性腹膜癌或输卵管癌患者。研究结果表明,经研究人员评估的客观缓解率(ORR)为32.4%,BICR评估的ORR为31.6%。根据ImmunoGen财报,索米妥昔单抗正在逐步放量,到2023年第一季度销售收入已达2950万美元。此外,ImmunoGen也进行了另一项III期MIRASOL验证性研究,希望将索米妥昔单抗在美国的加速批准转化为全面批准。2023年5月,MIRASOL研究取得了突破性进展,与化疗相比,索米妥昔单抗将患者总生存期(OS)从12.75个月提升到16.46个月,死亡风险降低33%,成为首个扩展FRα阳性铂耐药卵巢癌患者OS的新药;无进展生存期(PFS)从3.98个月提升到5.62个月。
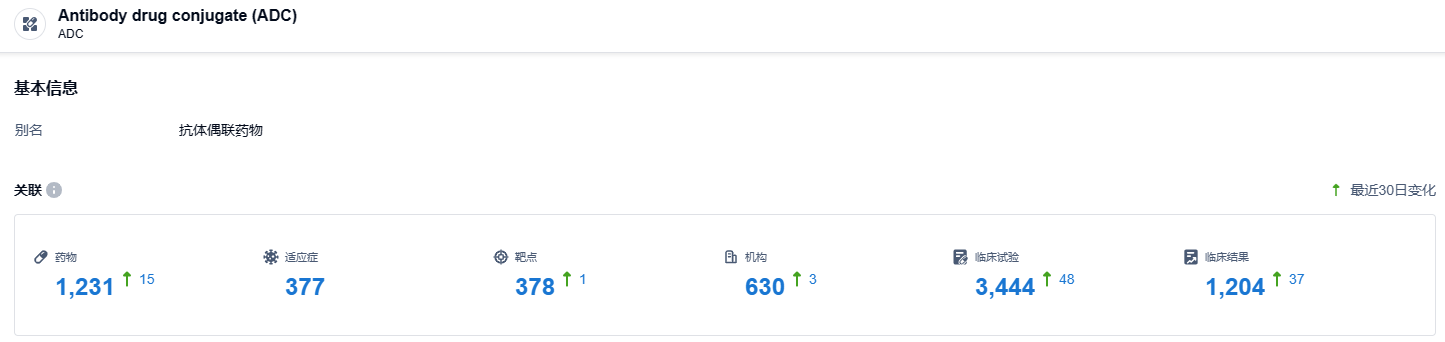
根据智慧芽新药情报库所披露的信息,截至2023年10月26日,ADC药物类型在研药物总数为1231个,包含适应症有377种,靶点378个,在研机构有630个,相关临床试验总共有3444项。期盼索米妥昔单抗能早日在国内上市,给国内病患提供新的治疗方案。