2023年11月2日,中国的国家药品监督管理局药品审评中心(CDE)在官方网站上公布,已经接收了由百济神州提交的泽尼达妥单抗的注射剂审批申请,这种药物被提议作为优先审评对象,适用于过去已经接受过全身治疗的HER2高表达的不可切除局部晚期或转移性胆道癌患者。
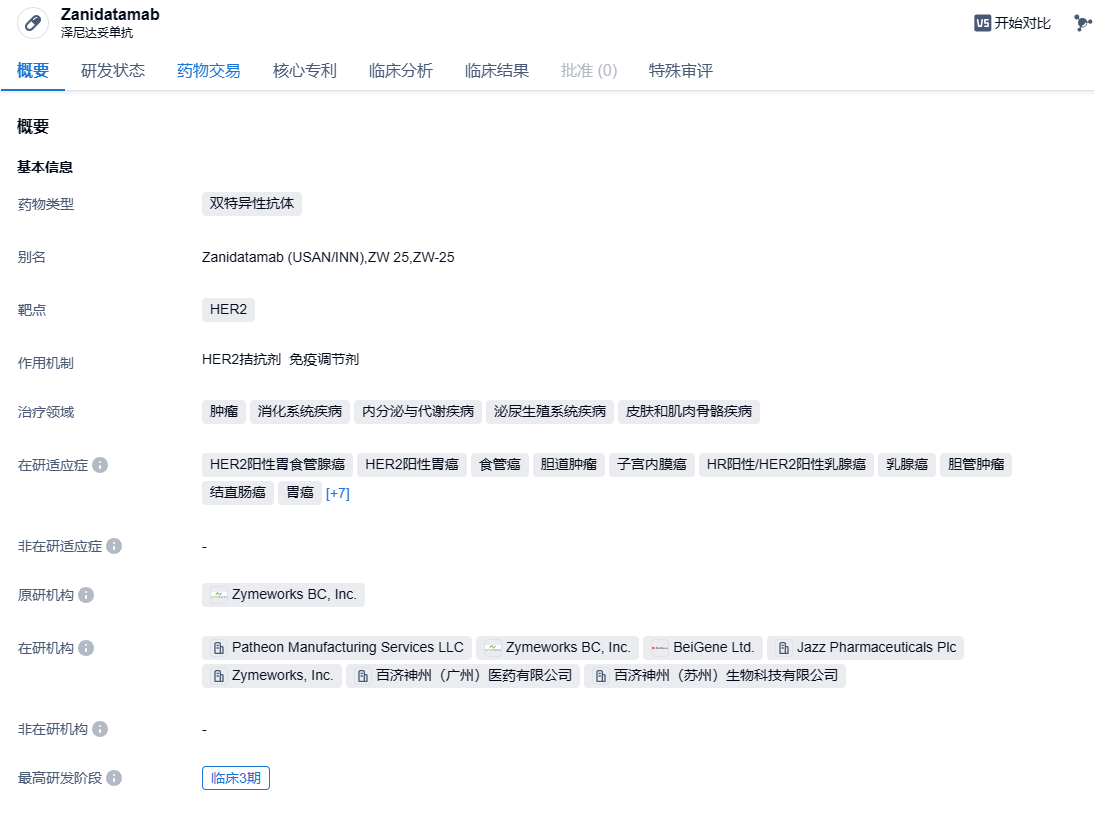
Zanidatamab(泽尼达妥单抗)是在Zymeworks公司的Azymetric平台开发的研究性双特异性抗体,它能同时与HER2的两个非重叠表位进行结合,所以也被称为双特异性结合。这个创新的设计引发了多种新的作用机制,包括双重HER2信号阻断、增强结合和从细胞表面清除HER2蛋白。这种药物在患者体内能产生令人鼓舞的抗肿瘤活性的强大效应器功能(effector function),这对胆道肿瘤的治疗具有极大的积极意义。2018年11月,百济神州与Zymeworks公司以大约4.3亿美元的高额资金,就两款处于研发阶段的HER2靶向双特异性抗体药物ZW25和ZW49的临床开发和推广达成合作。百济神州因此在亚洲(日本除外)、澳大利亚和新西兰获得了这两款候选药物的开发和推广的独家授权。
 (文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
据ASCO大会上的口头报告,HERIZON-BTC-01试验是一次开放标签的全球2b期研究,是针对在过去接受过含有吉西他滨治疗的HER2扩增的局部晚期不可切除或转移性胆道癌的患者进行。据研究人员所给出的结论,关键性的HERIZON-BTC-01试验的结果表明,HER2双特异性抗体泽尼达妥单抗在一线治疗难治性HER2阳性胆道癌患者中显示出迅速、持久的反应以及可控的安全性。
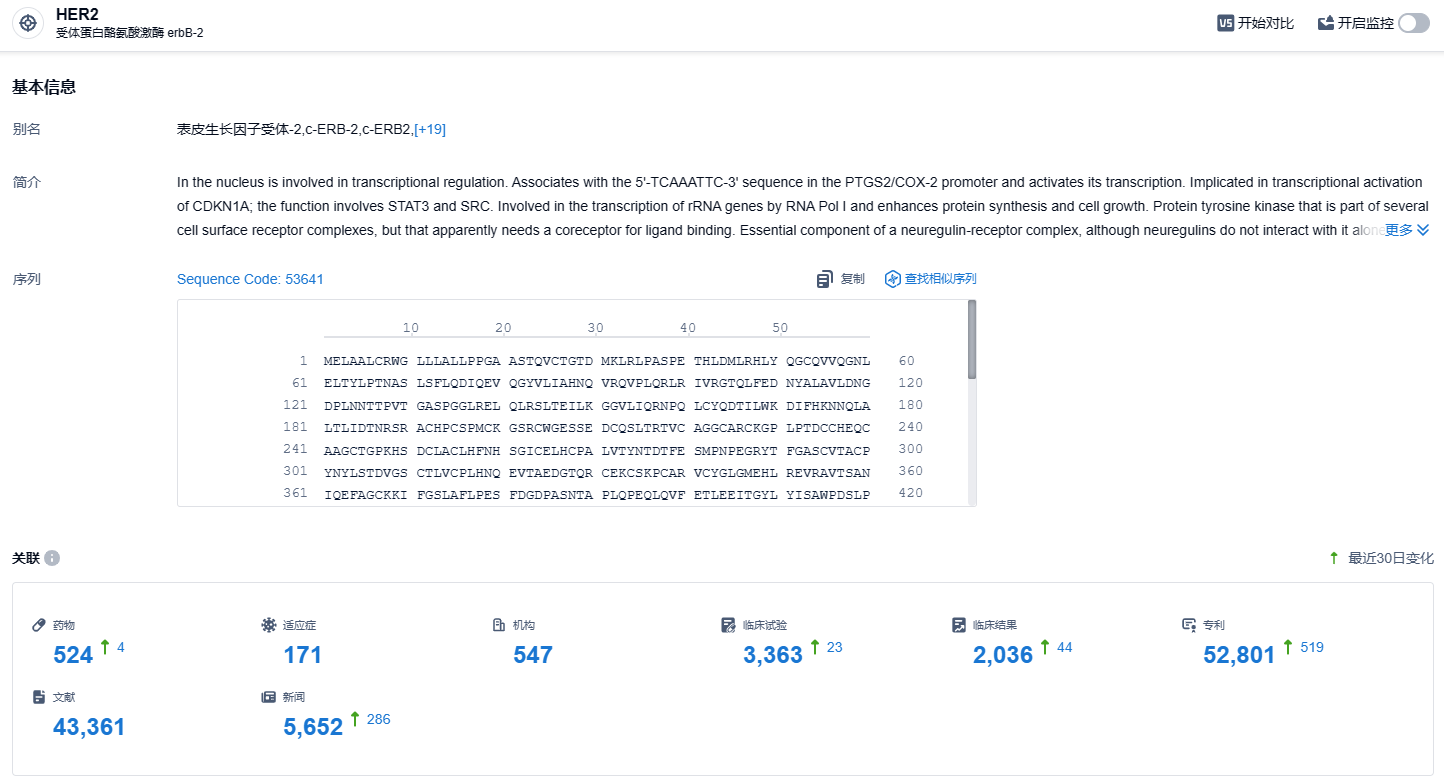
根据智慧芽新药情报库所披露的信息,截止到 2023 年11月3日,HER2靶点一共有研究药物524个,包含的病症种类有171种,547家机构在进行相关研究,涉及的临床试验达到3363件,专利达到52801件。关键性的HERIZON-BTC-01试验的结果表明,HER2双特异性抗体泽尼达妥单抗在一线治疗难治性HER2阳性胆道癌患者中显示出迅速、持久的反应以及可控的安全性。期待泽尼达妥单抗能进一步的研发进展顺利。