2023年11月2日,天境生物与HI-Bio共同宣布,美国FDA已授予差异化CD38抗体菲泽妥单抗以治疗原发性膜性肾病(PMN)的突破性疗法认定。这项认证基于包括M-PLACE研究(一项菲泽妥单抗治疗原发性膜性肾病的初步Ⅰb/Ⅱa概念论证、开放标签研究)在内的多个积极临床成果。
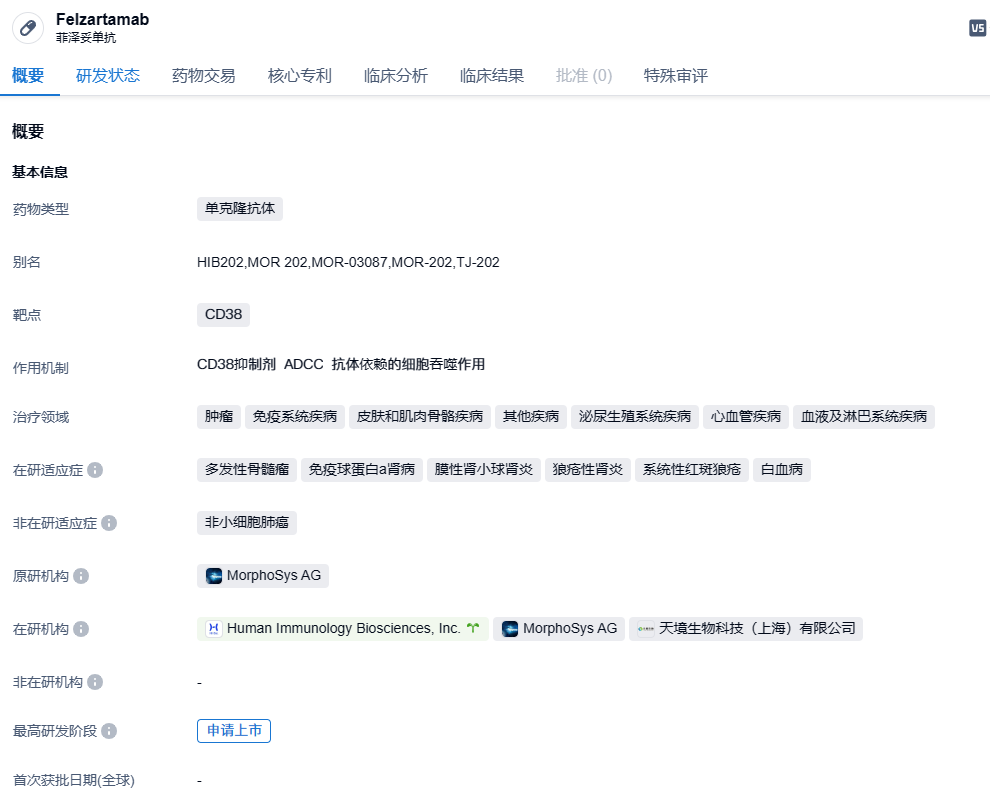
菲泽妥单抗是针对CD38(一种在成熟浆细胞上产生的蛋白)的在研的人源单克隆抗体。这个抗体所针对的多发性骨髓瘤表面CD38抗原,是恶性浆细胞表面表达最强烈、且均一的肿瘤抗原。这个抗体的运作机制是依靠抗体依赖性细胞毒性和抗体依赖性细胞吞噬来杀伤表达CD38的癌细胞,没有包含有补体依赖的细胞毒性作用(CDC)。研究表明,CD38抗体还有能对其他癌症及自身免疫性疾病进行治疗的可能性。根据天境生物与MorphoSys在2017年11月签署的授权协定,天境生物在大中华地区(包括中国大陆、中国台湾、中国香港和中国澳门)具有菲泽妥单抗所有适应症的独立开发和商业化权益。2022年6月,HI-Bio与MorphoSys签订持股授权许可协议,HI-Bio获得菲泽妥单抗在大中华区外所有地区的所有适应症的开发和商业化权益。
 (文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
之前,6月16日,天境生物宣布,其合作伙伴Human Immunology Biosciences(HI-Bio)用差异化CD38抗体菲泽妥单抗治疗PMN获美国FDA孤儿药资格认定。FDA授予菲泽妥单抗孤儿药资格认定和创新疗法认定,是对菲泽妥单抗治疗PMN具有潜力的肯定。菲泽妥单抗精确针对清除CD38+浆细胞的设计,并对更多由CD38+浆细胞触发产生的抗体引发的免疫介导性疾病,包括PMN、IgA肾病、抗体介导性排斥反应、和狼疮性肾炎等,都具有治疗适应性。
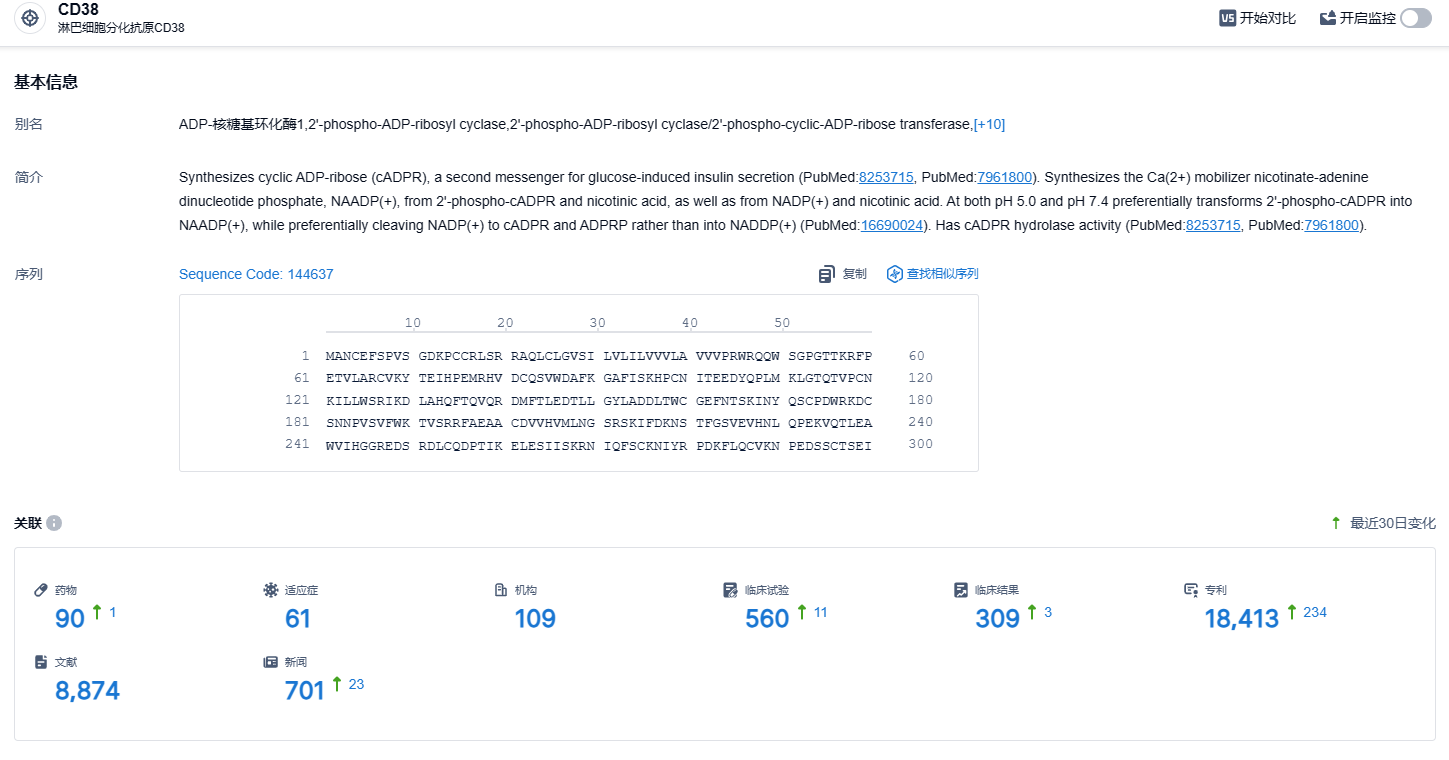
根据智慧芽新药情报库所披露的信息,截止到 2023 年11月4日,共有在研药物90个,涵盖的适应症达61种,共有研发机构109个,相关临床试验多达560项,专利高达18413项。菲泽妥单抗M-PLACE研究最终结果将在2023年11月1日至5日的美国肾脏病学会肾脏周(ASN Kidney Week 2023)由俄亥俄州立大学肾病学部门主任Brand Rovin博士公布,期待该药的表现。