2023年11月8日,中国国家药监局(NMPA)在其官方网站上公布了最新的信息,罗氏(Roche)申请的格罗菲妥单抗注射液(商业名称:高罗华/Columvi)已经通过优先审评审批程序并获得附条件批准,用于治疗既往接受过至少两线系统性治疗的复发或难治性弥漫大B细胞淋巴瘤成人患者。根据公开的信息,这是罗氏CD20 + CD3双特异性抗体(曾用名格罗菲妥单抗,Glofitamab,RO7082859)。
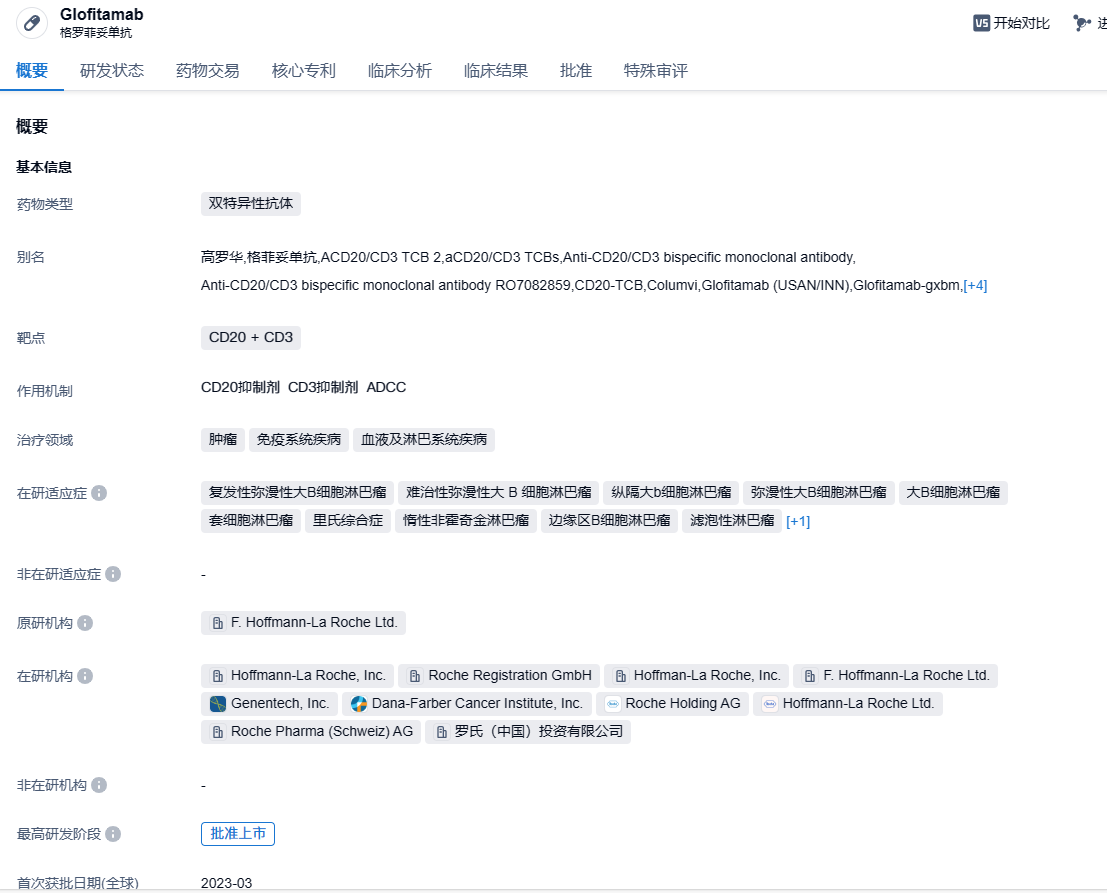
格菲妥单抗(Glofitamab)是一种能够同时靶向CD20 + CD3的双特异性抗体。其特殊性在于,作为一个抗体,它的两条臂是不同的。其中,一侧的Fab段是标准的CD20结合位点,而另一侧则是将一个抗CD20 Fab和抗CD3 Fab的柔性头尾相接,即具有2:1比例的CD20和CD3结合位点。抗CD20 Fab能有效锁定癌细胞,抗CD3 Fab能定位T细胞,这种独特的抗体结构设计使Glofitamab比1:1的TCB更能精确地定位B细胞,并能诱导更紧密和稳定的T细胞-癌细胞免疫突触。2023年6月15日,罗氏(Roche)旗下的Genentech宣布,美国FDA已批准Columvi(Glofitamab-gxbm)用于治疗复发或难以治疗的弥漫性大B细胞淋巴瘤(DLBCL)或由于滤泡性淋巴瘤引起的大B细胞性淋巴瘤(LBCL)的成年患者,这些患者已经接受过二线或者多线的系统治疗。
 (文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
FDA加速批准的基础是Columvi在1/2期NP30179研究中所展示出来的积极结果。这项研究包括了132例既往治疗后复发或难治的DLBCL患者,其中约三分之一的患者既往接受过CAR-T细胞治疗。此外,83%的患者在近期治疗中属于难治类型。该试验结果指标包括独立审评委员会评估的完全缓解率(主要终点),以及总缓解率、缓解持续时间、无进展生存期、安全性和耐受性(次要终点)。该研究的结果指出,使用Columvi治疗了一段固定的时间后,56%(74/132)的患者成功获得了总体缓解(OR),43%的患者获得了完全缓解(CR)。而超过三分之二的应答者持续应答至少9个月。总体缓解率是指完全缓解(癌症的所有体征和症状消失)与部分缓解(体内癌症数量减少)之和。中位缓解持续时间为1.5年(18.4个月)。该项研究的数据最近已在《新英格兰医学杂志》上发表。临床试验证明,Columvi为复发或难以治疗的弥漫性大B细胞淋巴瘤患者提供了通过固定周期时间免疫疗法达到完全缓解的可能性,且这种缓解状态可能在治疗结束后持续存在。
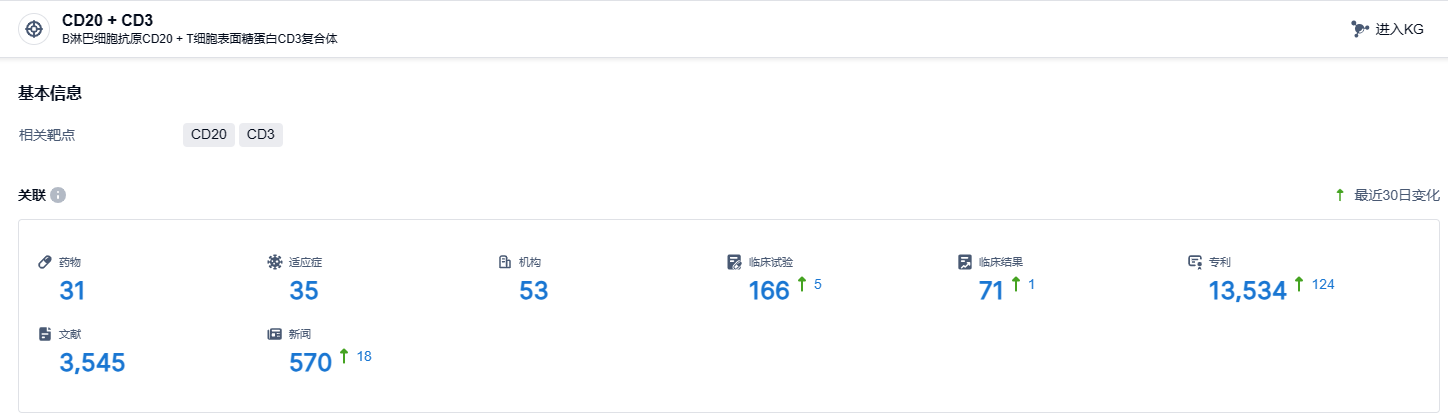
根据智慧芽新药情报库所披露的信息,截止到 2023 年11月9日,CD20 + CD3药物目标共有在研药物31个,包含适应症35种,研发机构53家,相关的临床试验共166项,专利数量高达13534件。格菲妥单抗的获批给了国内B细胞性淋巴瘤患者新的治疗选择。