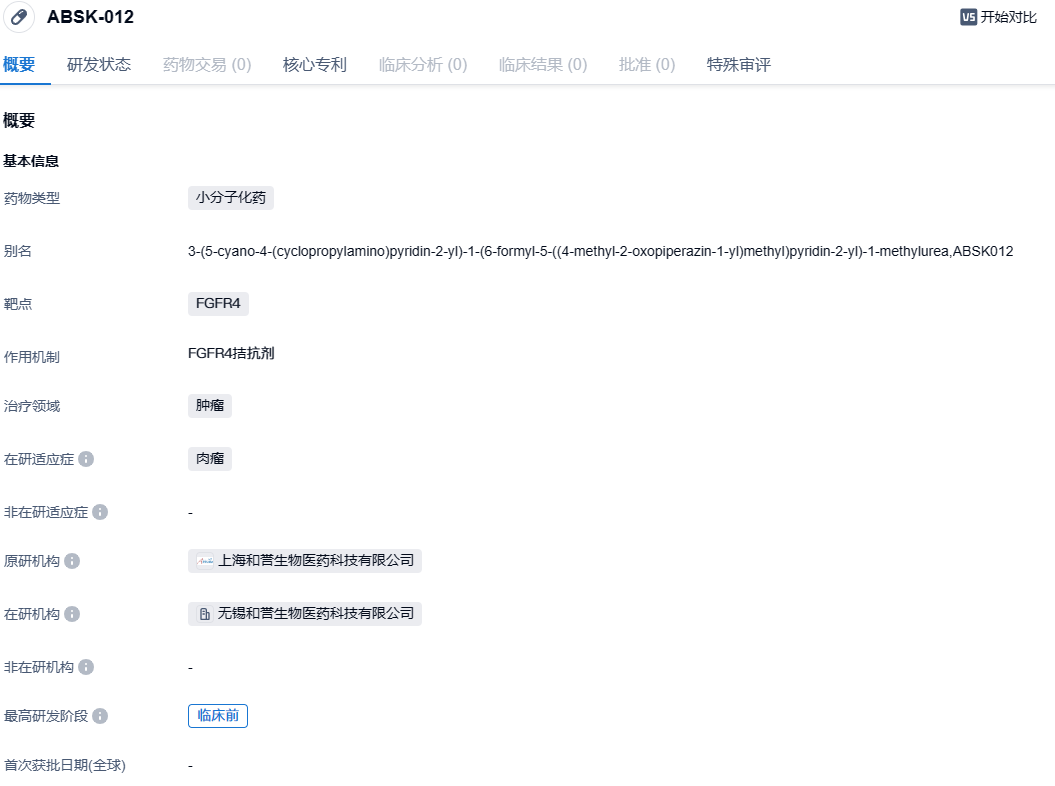
2023年11月8日,和誉医药公布,公司自主研发的抗耐药突变小分子成纤维细胞生长因子受体4(FGFR4)抑制剂ABSK012已得到美国FDA的批准可开展其单药在晚期实体瘤患者中的首次人体(FIH)I期临床试验。
ABSK012是一种具有高选择性的新型小分子FGFR4抑制剂,可克服对第一代抑制剂的FGFR4耐药突变。FGFR4信号途径是实体肿瘤(例如HCC、RMS)分子靶向治疗研发的重要方向。在临床前的研究中,ABSK012表现出抗肿瘤活性,并且具有优秀的药物代谢和药代动力学特性。2023年4月,ABSK012获得美国FDA的孤儿药资格认定,用于治疗软组织肉瘤(Soft Tissue Sarcoma简称STS)。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
本次批准的研究是一项开放的评价ABSK012在晚期实体瘤患者中的安全性、耐受性和药代动力学的一期临床研究。研究人群为具有特定基因改变的晚期实体瘤、FGF19过表达肝细胞癌(HCC)、FGFR4突变横纹肌肉瘤(RMS)等疾病患者。
纤维母细胞生长因子(FGFs)和它们的受体(FGFRs)对人类胚胎发生,血管生成,细胞增长和分化起关键作用,以FGFRs的异常激活,FGF/ FGFRs信号通路几乎参与到所有恶性肿瘤的发生和发展。GF19 与其受体 FGFR4 的过表达,通过激活无数下游信号通路,调控细胞的生存、增殖、侵袭和迁移等,诱发癌变。在人类肝癌样本中,FGF19和FGFR4异常表达与不良预后相关,过表达的FGF19 参与肝癌的发展。在鼠标实验中,过表达的FGF19促进肝细胞增殖,导致肝细胞发育异常,引发肝癌。使用FGFR4单克隆抗体能抑制过表达的FGF19小鼠中肝癌的形成和发展。
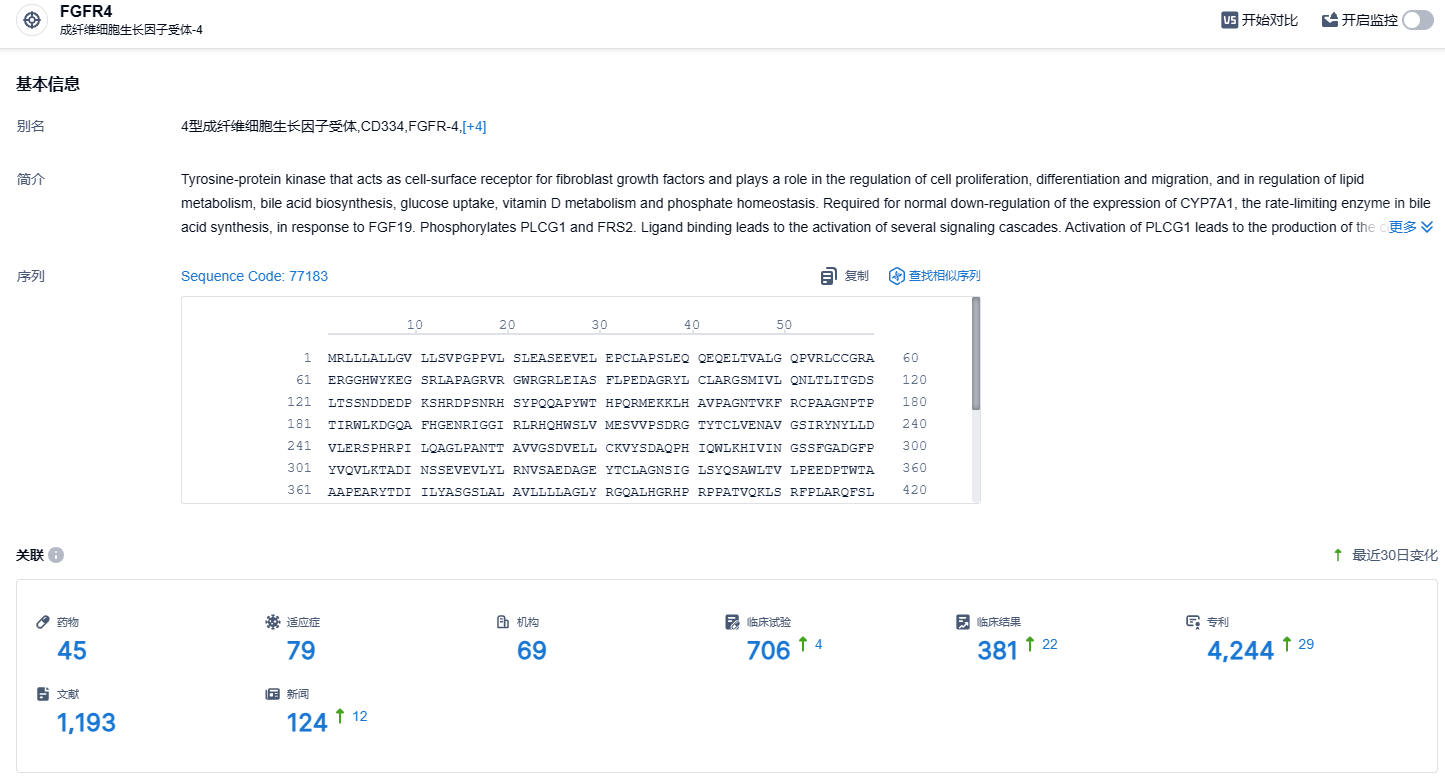
根据智慧芽新药情报库所披露的信息,截止到 2023 年11月9日,FGFR4靶点一共有45个正在研究的药物,包括79个可能的适应症,在研机构有69家,相关的临床试验有706个,申请的专利高达4244个。弗若斯特沙利文预计在2025年到2030年间,中国和全球FGFR4药物市场的复合年增长率分别为50.9%和60.1%,2026年中国和全球的FGFR4药物市场分别为2.08亿美元和5.55亿美元,2030年分别为7.40亿美元和24.35亿美元。我们期待ABSK012能在FGFR4靶向领域卓越出众。