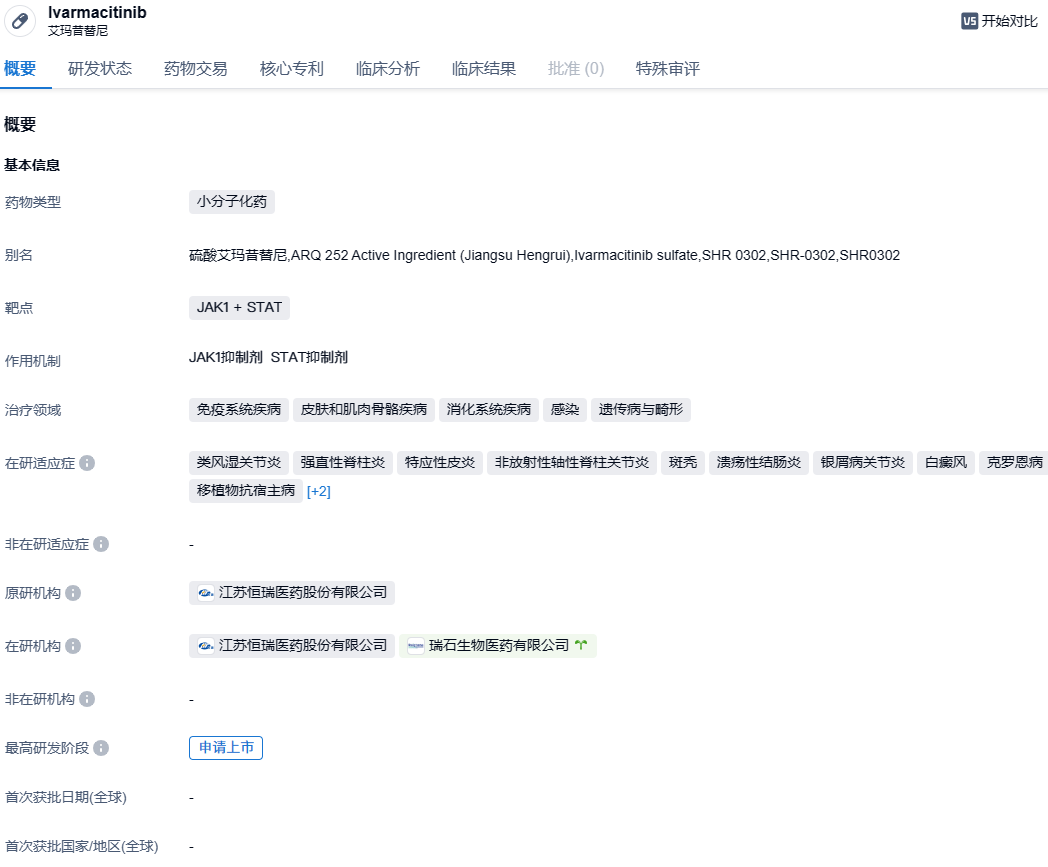
2023年11月8日,恒瑞医药宣布已收到中国国家药品监督管理局(NMPA)发出的《受理通知书》。该公告揭示恒瑞医药的SHR0302片(硫酸艾玛昔替尼片)上市申请已经获得正式受理,该药品的预计适应症为:用于对局部外用治疗或其他系统性治疗应答不充分或不耐受的成人和12岁及以上青少年中度至重度特应性皮炎患者。
硫酸艾玛昔替尼片,是一种JAK1抑制剂,具有很高的选择性,可以通过抑制JAK1信号传导发挥抗炎和抑制免疫反应的生物学效应。目前全球已有特应性皮炎口服JAK1抑制剂上市,如辉瑞的阿布昔替尼片(CIBINQO®)和艾伯维的乌帕替尼缓释片(RINVOQ®),然而尚未有国内企业自主研发的JAK1抑制剂上市。艾玛昔替尼片在2021年1月已被CDE列为创新性治疗产品。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
早前,SHR0302在中国提交了两份上市申请,一个用于治疗中重度特应性皮炎,另一个用于非甾体抗炎药(NSAIDs)治疗效果不佳或不耐受的活动性强直性脊柱炎的成年患者。
2022年11月,艾玛昔替尼治疗特应性皮炎III期临床研究RSJ10333(QUARTZ 3)达到研究设定的共同主要终点及所有关键次要终点,这使其成为自免疾病治疗领域第一个成功通过关键III期研究的国内自主研发的JAK1抑制剂。RSJ10333是一项评估口服艾玛昔替尼片与安慰剂在治疗中重度特应性皮炎的有效性和安全性的随机、双盲、安慰剂对照的多中心III期临床研究。研究结果表明,对12岁及以上中重度特应性皮炎患者进行16周的艾玛昔替尼片治疗,每天一次,无论是8mg还是4mg的剂量,都比安慰剂组在IGA 0/1应答和EASI 75应答方面表现出明显的优势。在改善皮肤痒的症状上,艾玛昔替尼在服药后的两天内就可以见效,治疗1周至16周,艾玛昔替尼8mg和4mg组最严重瘙痒数字评分改善≥4分的受试者比例均显著高于安慰剂组(P值均<0.001)。
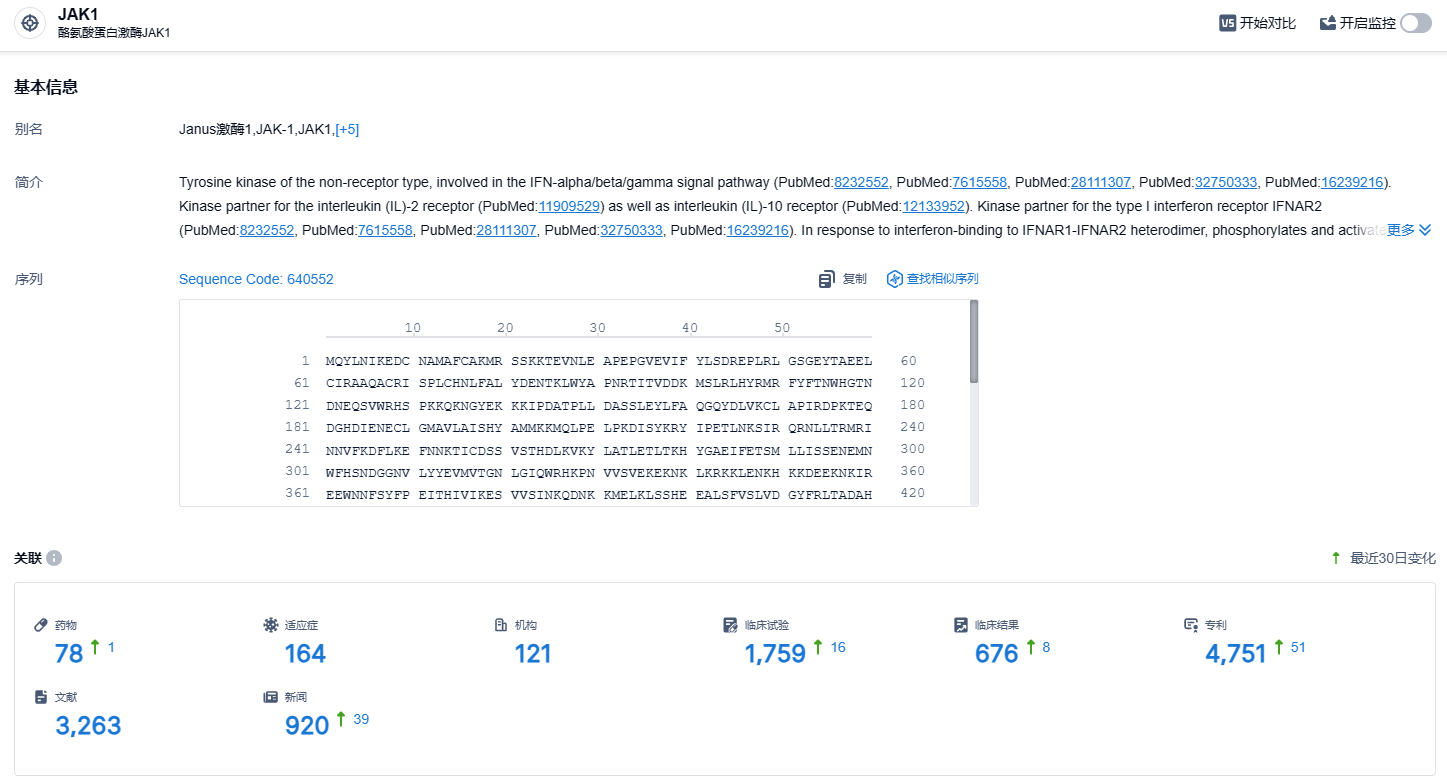
根据智慧芽新药情报库所披露的信息,截止到 2023 年11月10日,已经有78种JAK1靶点的在研药物,包括了164种疾病适应症,121个研究机构,以及1759个相关的临床试验和4751项专利。随着2022年JAK抑制剂市场的增长,现已近百亿美元的市值,原有的泛JAK抑制剂因其早期上市的优势而依然占据主导地位。然而,二代JAK抑制剂乌帕替尼,以艾伯维公司为首的新一轮竞争,正在逐渐取代原有的JAK抑制剂市场份额。我们期待艾玛昔替尼片能够尽速上市,在JAK抑制剂市场竞争中胜出。