2023年11月20日,中国国家药监局药品审评中心(CDE)官网公示,安进(Amgen)申报的1类新药AMG 133在中国获得临床试验默示许可,拟开发用于体重控制。
AMG 133是一种双特异性葡萄糖依赖性胰岛素性多肽受体(GIPR)拮抗剂和胰高血糖素样肽-1 (GLP-1)受体激动剂分子,属于一款GIPR + GLP-1R抗体多肽偶联药物(PDC)。AMG 133模拟GLP-1的激动剂作用,并拮抗葡萄糖依赖性胰岛素性多肽(GIP)的作用。安进获批临床是基于人类遗传学的洞察力和临床前证据,表明GIP受体阻断和GLP-1受体激动作用对体重减轻和其他代谢参数的改善有协同作用。
与临床上多款GIPR/GLP-1R双重激动剂机制有所不同,AMG 133是一种双特异性GIPR拮抗剂和GLP-1R激动剂分子,它在抑制GIPR的单克隆抗体上偶联了GLP-1类似物。这款在研疗法可以在激活GLP-1受体的同时抑制GIPR的活性,从而调节与肥胖症和代谢失调相关的多个信号通路。其中,激活GLP-1R可延缓胃排空和抑制食欲,进而达到减重的效果。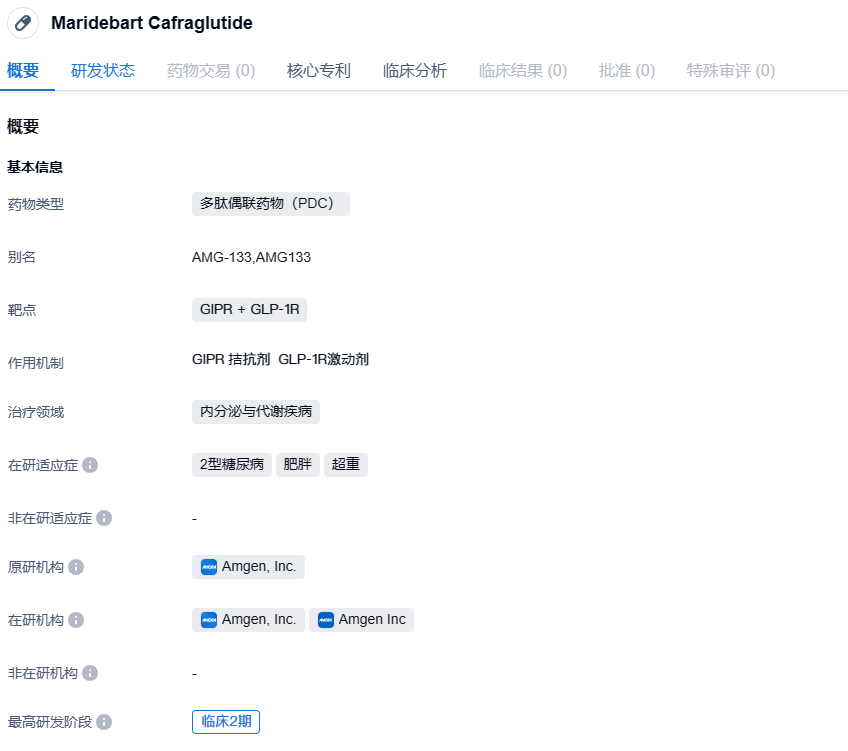
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
2022年12月,安进公布了AMG 133的最新1期临床试验数据,该研究旨在评估AMG 133在肥胖和无糖尿病人群中的安全性、耐受性、药代动力学和药效学特征。受试者随机接受皮下注射AMG 133或安慰剂治疗,试验分为单次递增剂量(SAD)或多次递增剂量(MAD)两个队列。MAD队列研究结果显示,第85天(约3个月)时,与基线相比,接受低剂量(140mg,每四周给药一次)和高剂量(420mg,每四周给药一次)的两组受试者,体重平均下降了7.2%和14.5%。AMG133的安全性良好,研究中没有发现明显的安全问题,大多数的不良反应较轻微且短暂,都与胃肠道有关,其中恶心和呕吐最常见,大多数事件在48小时内消退。
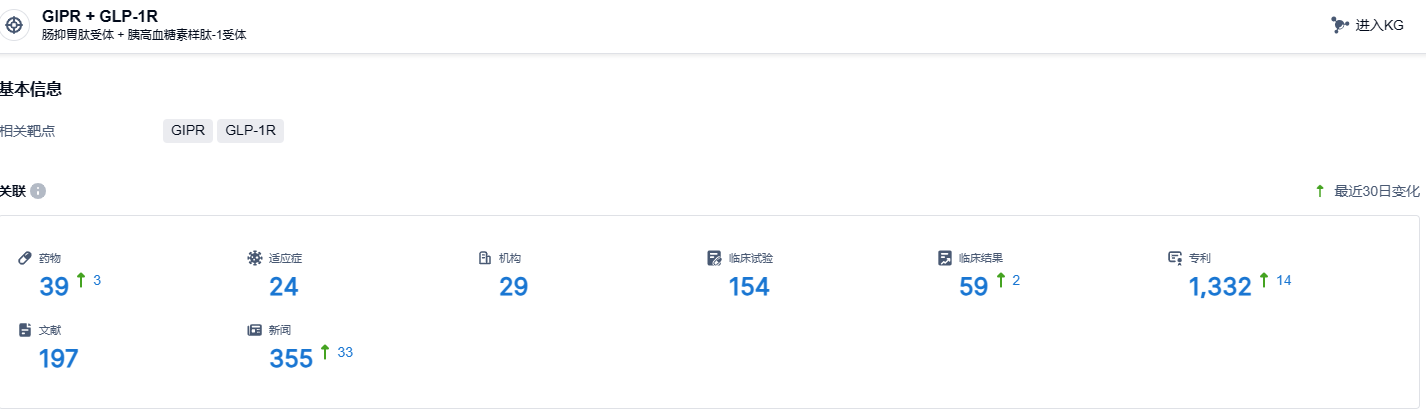
根据智慧芽新药情报库所披露的信息 (点击下方图片直达GIPR + GLP-1R靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年11月22日,GIPR + GLP-1R靶点共有在研药物39个,包含的适应症有24种,在研机构29家,涉及相关的临床试验154件,专利多达1332件……根据ClinicalTrials官网,安进已经启动了一项2期临床研究,旨在比较和评估与安慰剂相比,3种选定剂量的AMG 133在超重或肥胖无糖尿病患者、超重或肥胖合并2型糖尿病患者中诱导和维持52周的有效性、安全性和耐受性的剂量范围。期待AMG 133的后续表现。