2023年11 月 27 日,赛诺菲宣布,度普利尤单抗(Dupixent)治疗慢性阻塞性肺病(COPD)的 III 期临床 NOTUS 研究达到主要终点。这是针对 Dupixent 治疗中重度 COPD 开展的第 2 项 III 期临床试验,此前,首项 III 期临床 BOREAS 研究已取得积极结果。赛诺菲表示将在今年年底递交该适应症的上市申请,有望成为首款 COPD 生物制剂创新药。
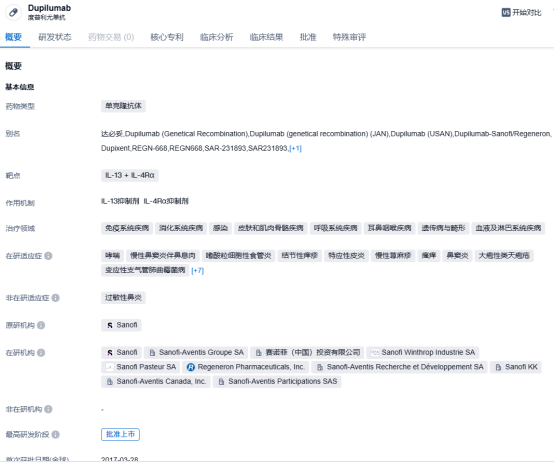
度普利尤单抗是赛诺菲和再生元合作开发的一款人源性单克隆抗体,靶向IL-4Rα。通过结合 IL-4Rα,度普利尤单抗可同时阻断IL-4 和IL-13信号通路,IL-4和IL-13 被认为是特应性皮炎持续性炎症的主要驱动因子。2017 年 3 月,度普利尤单抗获FDA批准成为首个用于治疗成人中重度特应性皮炎的靶向生物药,商品名为 Dupixent®。度普利尤单抗在国内首次上市批准时间为 2020年6月,用于治疗成人中重度特应性皮炎。随后,又陆续申报两项适应症,分别针对 12 岁及以上的中重度特应性皮炎患者,以及6~12岁的中重度特应性皮炎患者,均以儿童用药的理由纳入优先审评审批并取得批准。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
NOTUS 研究旨在评估 Dupixent 在目前接受最大标准吸入治疗(三联治疗)且伴发 2 型炎症(血液嗜酸性粒细胞 ≥ 300 个/μL)的成年 COPD 患者的疗效、安全性和耐受性。该研究共纳入 935 例患者,该类患者曾经或目前吸烟。研究结果显示达到主要终点,接受 Dupixent 治疗 52 周,中重度 COPD 的急性发作减少 34%(p=0.0002)。此外,第 12 周时,Dupixent 治疗组患者肺功能(通过支气管扩张剂前 FEV1 评估肺功能)较基线提高 139 mL,安慰剂组为 57 mL(p=0.0001),益处持续到第 52 周,Dupixent 组为 115 mL,安慰剂组则为 54 mL(p=0.0182)。在安全性方面,与 Dupixent 在已批准适应症的安全性数据基本一致。Dupixent 不良事件(AE)发生率为 67%,安慰剂组为 66%,常见 AE 包括鼻咽炎、头痛等。
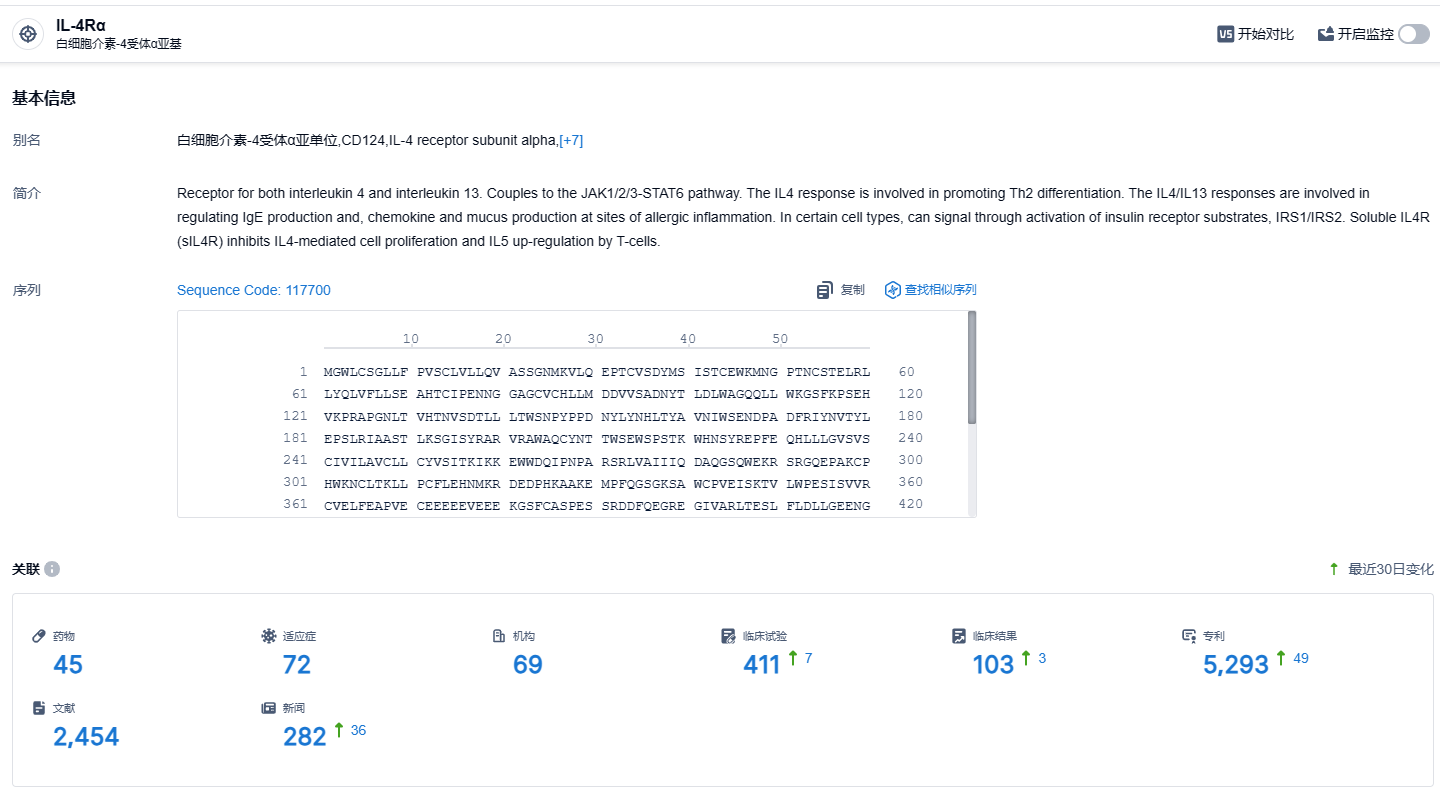
根据智慧芽新药情报库所披露的信息 (点击下方图片直达IL-4Rα 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年11月28日,IL-4Rα 靶点共有在研药物45个,包含的适应症有72种,在研机构69家,涉及相关的临床试验411件,专利多达5293件……度普利尤单抗是第一款领域横跨皮肤科、呼吸科、变态反应用药的生物制剂,优秀的临床数据,使得其具有非常强的市场潜力。自2017 年上市以来度普利尤单抗全球销售额增长迅速,至2022 年达到82.93 亿欧元。期待度普利尤单抗销售额突破百亿美元。