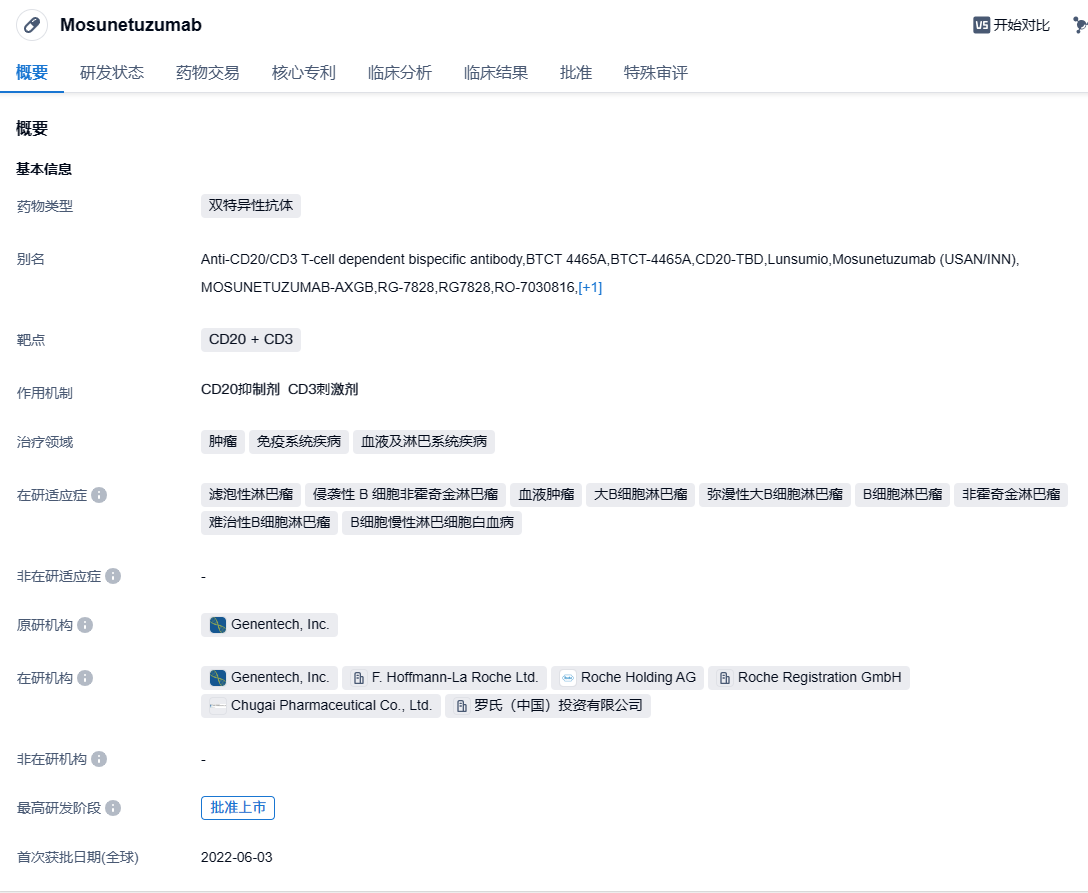
2023年11月30日,中国国家药监局药品审评中心(CDE)官网公示,罗氏(Roche)申报的mosunetuzumab(RO7030816)拟纳入优先审评,适用于治疗既往接受过至少两种系统性治疗的复发或难治性滤泡性淋巴瘤(FL)成人患者。这是罗氏的“first-in-class”双特异性抗体疗法Lunsumio,此前已经在欧盟和美国获批用于治疗经过两种或多种前期系统治疗后复发或难治FL成年患者。
Mosunetuzumab是罗氏公司开发的一款CD20 + CD3双抗,于2022年6月在欧盟获得附条件上市批准,用于治疗至少接受过2次系统治疗的R/R FL成年患者,成为了全球首个获批上市CD20/CD3双抗。同年12月,Mosunetuzumab又获得FDA上市批准。它可以引导患者体内的T细胞迁移到目标B细胞附近,并且释放细胞毒性的蛋白消灭B细胞。Mosunetuzumab以静脉输注的形式给药,持续时间固定,允许休息治疗,也可以在门诊输液。此前,该药还曾获FDA授予突破性疗法认定和孤儿药资格。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
Mosunetuzumab的上市批准基于一项2期GO29781研究(NCT02500407),该研究是一项多中心、开放标签、剂量递增和扩展研究,用以评估Mosunetuzumab在复发性或难治性B细胞非霍奇金淋巴瘤的疗效和安全性。在中位随访 18.3 个月后,反应者的中位反应持续时间(mDoR)为 22.8 个月(95% CI:9.7-不可估计),完全反应率为 60%(n=54/90),客观反映率为 80% (n = 72/90)。最常见的不良事件是细胞因子释放综合征(39%),通常为低级别(2 级:14%),并在治疗结束时消退。其他常见 (≥ 20%) AE 包括中性粒细胞减少、发热、低磷血症和头痛。
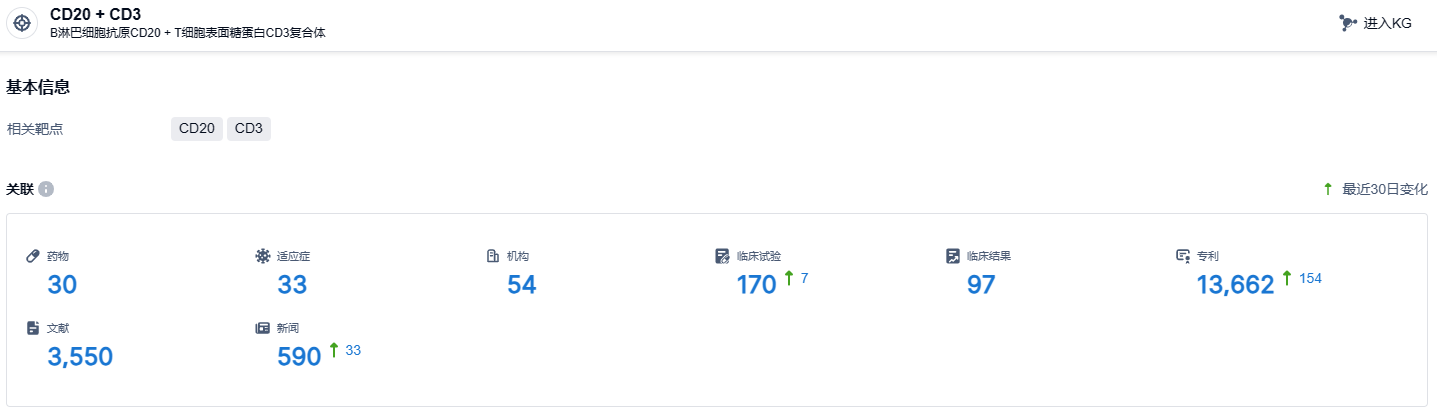
根据智慧芽新药情报库所披露的信息 (点击下方图片直达CD20 + CD3 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年12月1日,CD20 + CD3 靶点共有在研药物30个,包含的适应症有33种,在研机构54家,涉及相关的临床试验170件,专利多达13662件……目前Mosunetuzumab正在国内开展两项 III 期临床,除滤泡性淋巴瘤外,还针对 B 细胞非霍奇金淋巴瘤。期待该药早日上市。