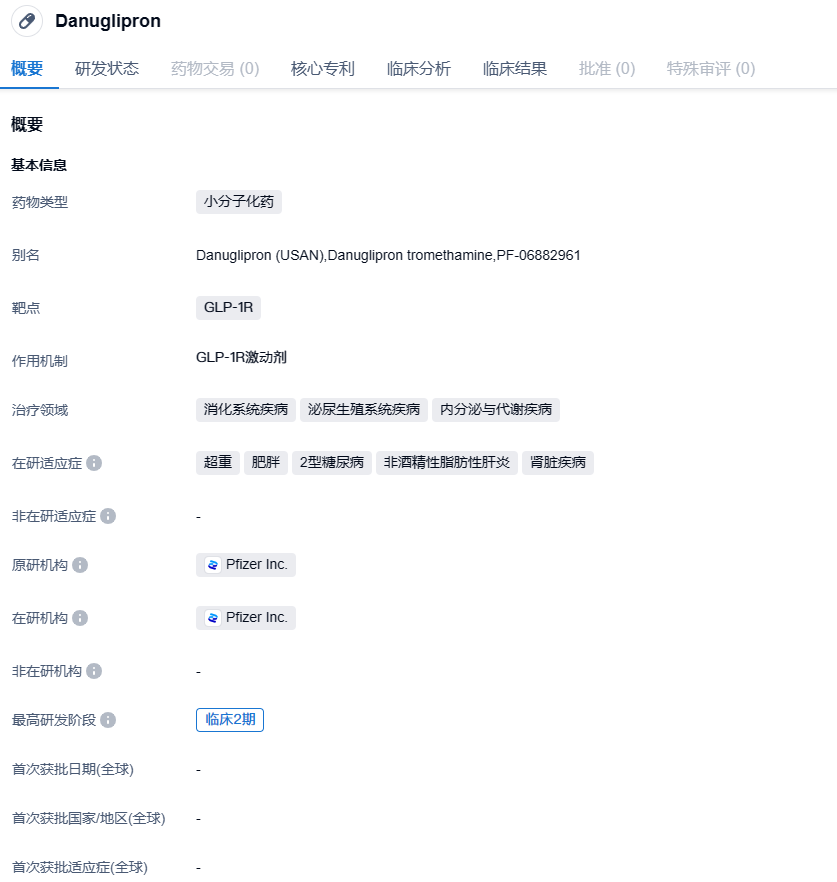
2023年12月1日,辉瑞公布了口服小分子胰高血糖素样肽-1受体激动剂(GLP-1RA)Danuglipron(PF-06882961)用于成人肥胖(非2型糖尿病)患者的IIb期临床试验(NCT04707313)的数据。该研究达到了主要终点,患者体重较基线有统计学上的显著变化。不过辉瑞表示,不计划将这款每日口服两次的药物推进至III期临床阶段。
Danuglipron(PF-06882961)是一种实验性药物,以片剂形式口服,目前尚未被卫生当局批准使用。Danuglipron是辉瑞公司内部发现和开发的,是一种小分子口服GLP-1R药物。这种药物旨在将血糖保持在健康水平,并通过增加释放的胰岛素量和降低释放到血液中的胰高血糖素量来发挥作用。它还会减慢食物的消化速度,增加进食后的饱腹感。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
Danuglipron的给药频率为每日两次(BID),结果显示,其所有剂量组患者体重均较基线有统计学意义上的显著减轻,在第32周时,Danuglipron组体重平均减少范围为-6.9%至-11.7%,而安慰剂组为+1.4%;在第26周时,Danuglipron组体重平均减少范围为-4.8%至-9.4%,而安慰剂组为+0.17%。经安慰剂调整后,Danuglipron组第32周平均体重下降幅度为-8%至-13%,第26周为-5%至-9.5%。根据滴定计划,参与者从第6至24周内处于目标剂量水平。与作用机制相关的胃肠道副反应发生率较高(恶心:73%;呕吐:47%;腹泻:25%)。所有剂量的停药率均高于50%,而安慰剂约为40%。没有新的安全性信号报道,与安慰剂相比,接受Danuglipron治疗与肝酶升高发生率增加无关。这项研究的数据将在未来的科学会议上发表,或发表在同行评议期刊上。
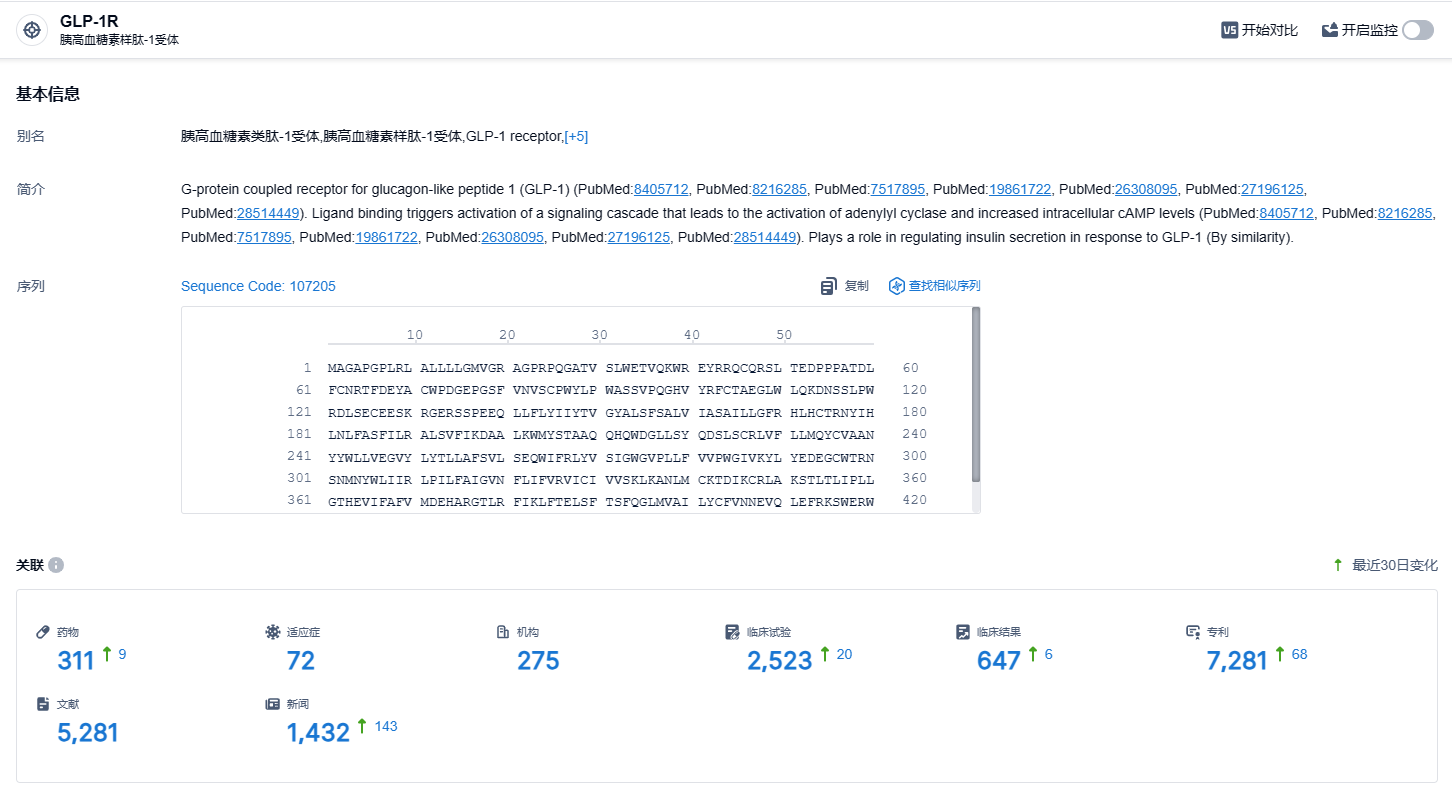
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达GLP-1R靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年12月2日,GLP-1R靶点共有在研药物311个,包含的适应症有72种,在研机构275家,涉及相关的临床试验2523件,专利多达7281件……不过辉瑞表示Danuglipron的未来开发将集中在每日一次的配方上,药代动力学数据预计将在2024年上半年公布。而Danuglipron每日两次的制剂将不会被推进至III期研究阶段。