2023年12月11日,诺华宣布,其口服补体B因子抑制剂iptacopan(伊普可泮)治疗C3肾小球病的III期APPEAR-C3G研究达到主要终点。
伊普可泮(iptacopan)是诺华在研的一款潜在“first-in-class”口服补体途径因子B(CFB)抑制剂,此前曾被CDE纳入突破性治疗品种,拟用于治疗PNH。伊普可泮作用于补体系统C5末端通路的上游,同时控制血管内溶血和血管外溶血,弥补了抗C5抗体的不足,同时为患者提供了口服单药的治疗选择。2023年6月5日,盐酸伊普可泮胶囊在国内拟纳入优先审评,拟纳入的理由是符合临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药。2023年6月14日,CDE官网显示,诺华盐酸伊普可泮胶囊(iptacopan)上市申请获受理,用于成人阵发性睡眠性血红蛋白尿症(PNH)患者的治疗。2023年12月6日,诺华公司(Novartis)宣布,美国FDA批准Fabhalta(iptacopan,伊普可泮)上市,作为治疗成人阵发性夜间血红蛋白尿症(PNH)的首个口服单药疗法。Fabhalta是一种补体B因子抑制剂,它在免疫系统的替代补体途径中起作用,全面控制血管内外的红细胞(RBC)破坏。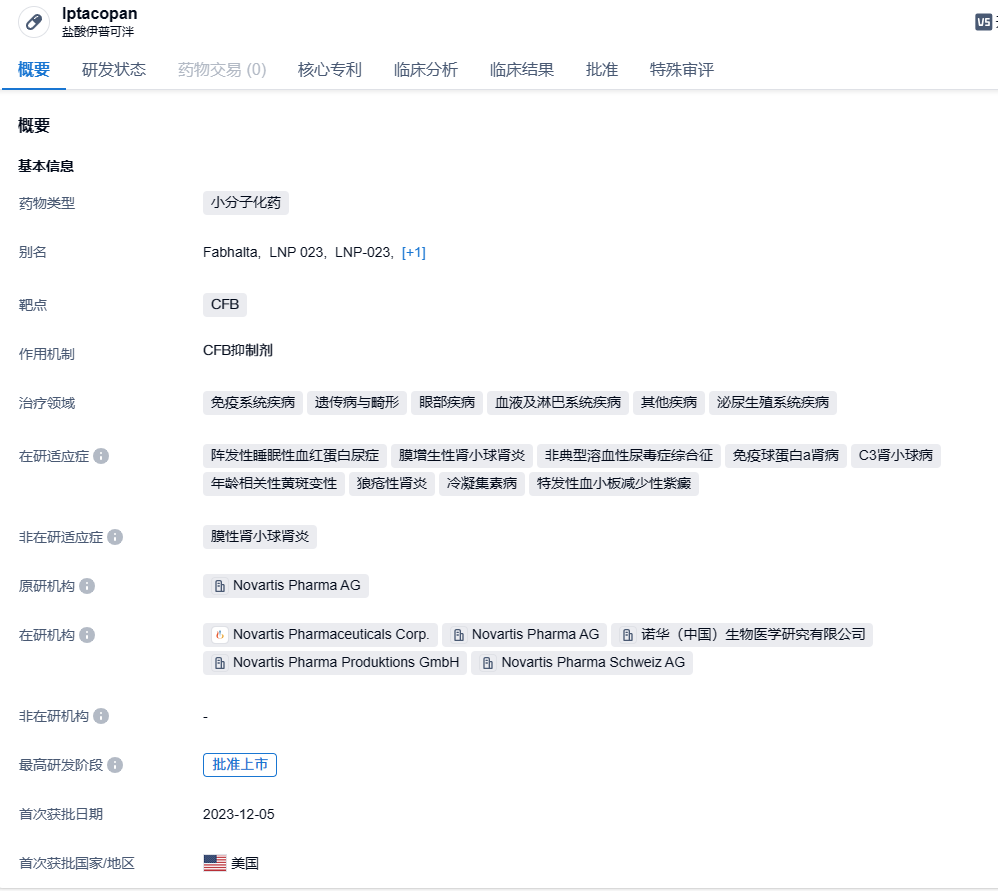 (文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
诺华制药报告了六个月双盲期的针对C3肾小球病患者治疗的iptacopan III期APPEAR-C3G的积极顶线结果。在6个月的背景治疗基础上,iptacopan(200mg,每天两次)相较于安慰剂在减少蛋白尿方面具有优势,且这种减少具有临床意义和统计学意义。Iptacopan的安全性与之前报告的数据一致。APPEAR-C3G研究将继续进行为期6个月的开放标签期,所有患者都将接受iptacopan治疗,包括之前接受安慰剂治疗的患者。此外,另一项针对C3G青少年患者的队列研究也在进行中。诺华制药计划与全球卫生当局审查结果,以便于2024年可能提交申请。
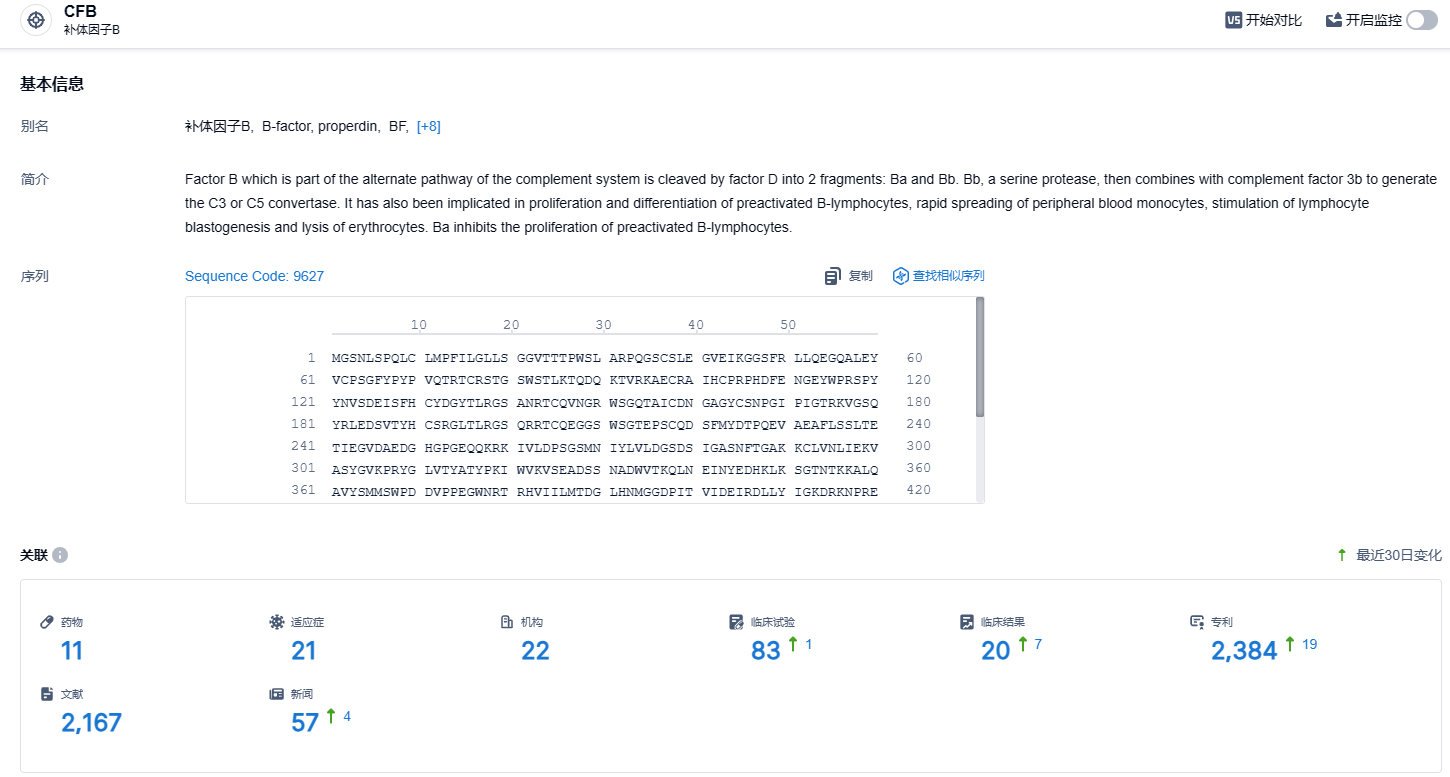
根据智慧芽新药情报库所披露的信息(点击下方卡片直达CFB靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到2023年12月12日,CFB靶点共有在研药物11个,包含的适应症有21种,在研机构22家,涉及相关的临床试验83件,专利多达2384件……伊普可泮试验数据优秀,有望成为CFB靶点领域best in class的存在,期待该药早日在国内上市,给患者带来新的治疗选择。