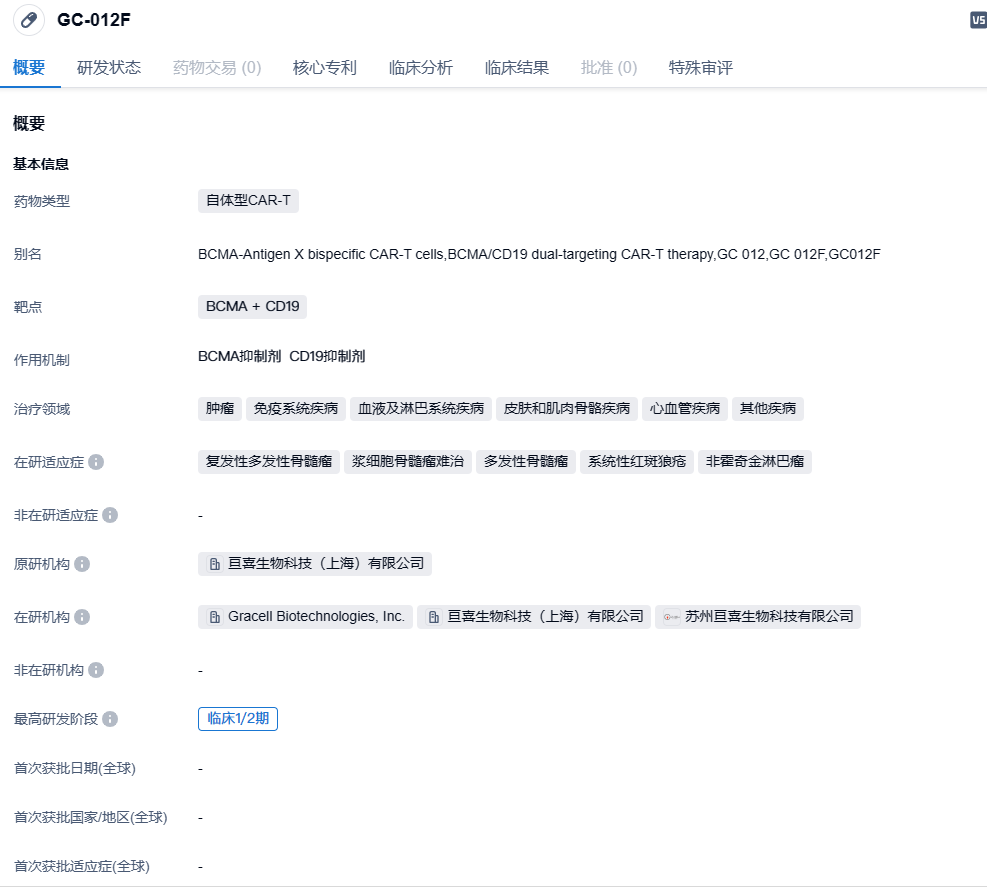
2023年12月12日,亘喜生物宣布在第65届美国血液学会(ASH)年会上以口头报告形式公布了一项GC012F治疗多发性骨髓瘤新确诊(NDMM)患者的由研究者发起的临床试验(IIT)最新研究结果。
GC012F是一款基于亘喜生物的FasTCAR技术平台开发的BCMA + CD19双靶点自体CAR-T细胞疗法,有望为癌症和自身免疫性疾病带来新的治疗选择,并具备差异化的安全性优势。目前,亘喜生物正在开展FasTCAR-T GC012F的多项临床研究,适应症覆盖多种血液肿瘤和自身免疫性疾病。临床数据显示,该药物在临床研究中展现出了良好的有效性和安全性。亘喜生物已在美国启动了一项评估 GC012F治疗复发/难治性多发性骨髓瘤(RRMM)的1b/2期IND临床试验,在中国也即将启动同适应症的1/2期IND临床试验。此外,美国FDA已经批准了GC012F针对难治性系统性红斑狼疮(rSLE)的IND申请,同时,一项针对同适应症的由研究者发起的临床试验也已启动。2023年11月27日,亘喜生物宣布其CD19/BCMA双靶点自体FasTCAR-T细胞疗法GC012F的又一项新药临床试验(IND)申请获得美国FDA批准,将在美国启动治疗难治性系统性红斑狼疮(rSLE)的1/2期临床试验。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
截至2023年10月1日数据截止日,22例符合移植条件的高危NDMM患者在接受了GC012F治疗后,展现出100%的总体应答率(ORR)和95%的微小残留病灶阴性(MRD-)严格完全缓解(sCR)率。其中,16例为既往随访患者,2022年ASH年会期间已发表过首次临床数据;另外6例为新入组接受治疗的患者。在本针对前线治疗的临床试验中,数据显示GC012F耐受性良好,未观察到新的安全性信号。
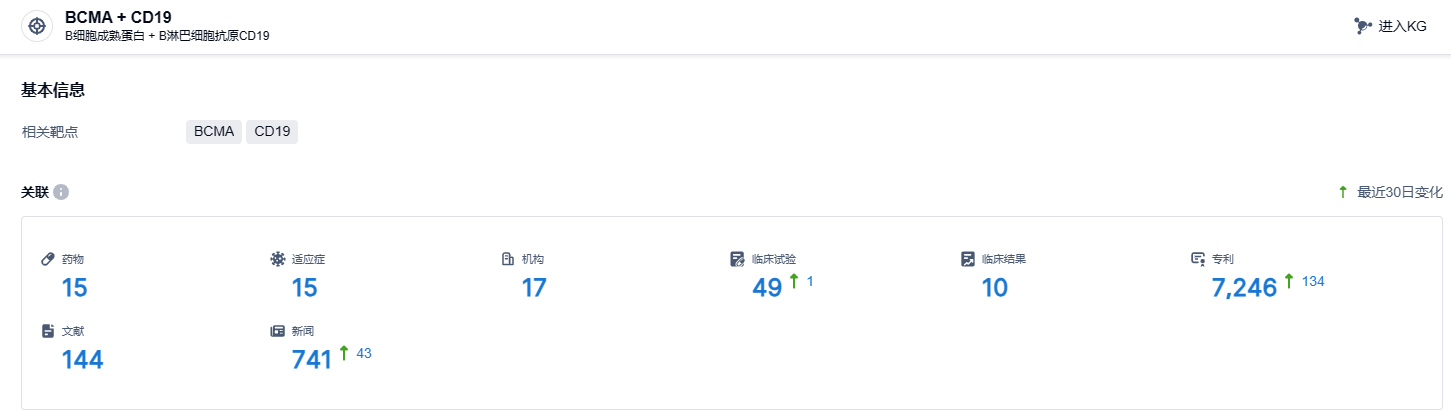
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达BCMA + CD19靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年12月13日,BCMA + CD19靶点共有在研药物15个,包含的适应症有15种,在研机构17家,涉及相关的临床试验49件,专利多达7246件……FasTCAR-T GC012F目前正处于一系列临床试验中,以探索其针对多发性骨髓瘤、B细胞非霍奇金淋巴瘤以及系统性红斑狼疮的治疗效果。目前这些疾病仍有大量的临床需求尚未被满足,期待GC012F能够给患者带来新的治疗选择。