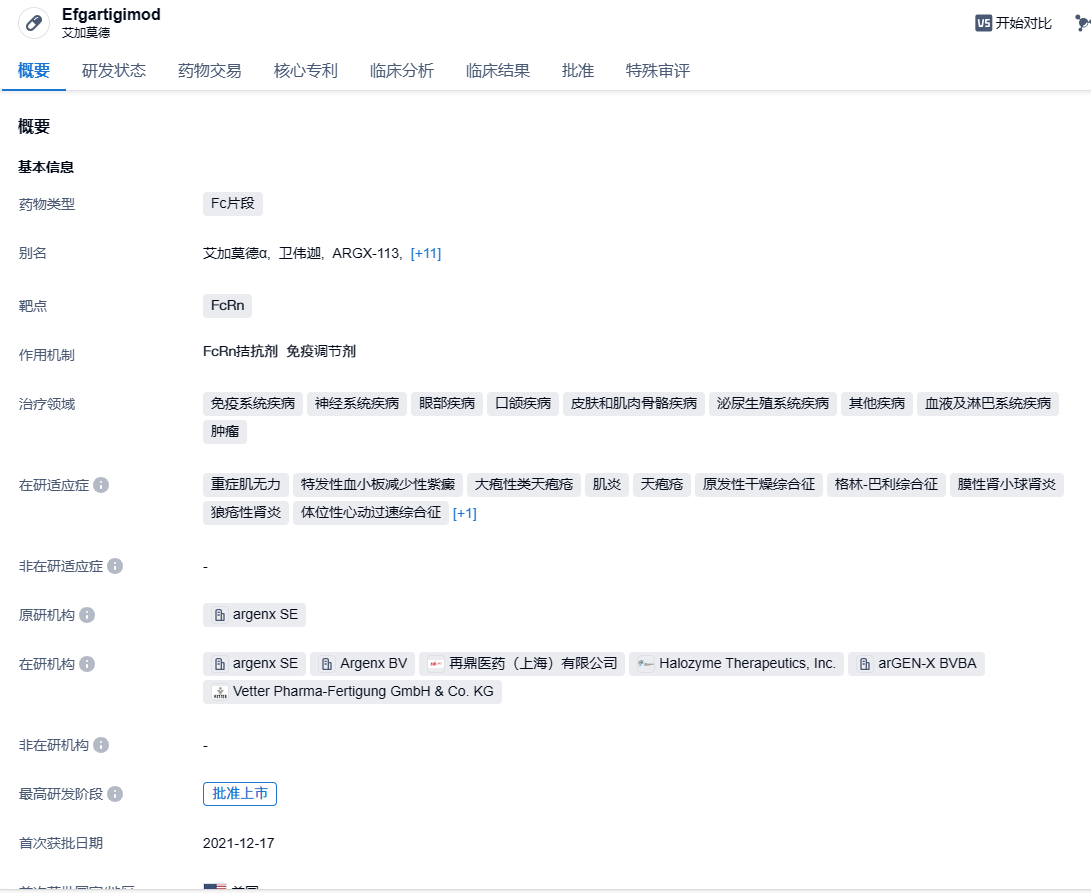
2023年12月20日,Argenx公布了艾加莫德皮下注射剂(efgartigimod SC)治疗天疱疮III期ADDRESS研究的最新数据,efgartigimod SC组与安慰剂组使用最小剂量皮质类固醇达到持续完全缓解(CRmin)的寻常型天疱疮(PV)患者比例没有显著差异。Argenx表示,将不会对天疱疮适应症进行进一步开发。
艾加莫德皮下注射剂是由人IgG1抗体的Fc片段艾加莫德α静脉输注(商品名卫伟迦®)和重组人透明质酸酶PH20(rHuPH20)共同配制,使用Halozyme的ENHANZE®药物递送技术将生物制剂通过皮下注射给药。艾加莫德皮下注射可与新生儿Fc受体(FcRn)结合,使循环IgG水平降低。艾加莫德α注射液(皮下注射)是皮下注射剂型的艾加莫德α注射液和重组人透明质酸酶PH20的中国国际非专利药品名称。其在美国以VYVGART Hytrulo的商品名上市,在其他地区获批后可能以不同的商品名上市。再鼎医药与argenx达成独家许可协议,在大中华区(中国内地、香港、澳门和台湾地区)开发和商业化艾加莫德。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
ADDRESS是一项随机双盲、安慰剂对照的全球多中心III期临床,旨在评估efgartigimod皮下注射剂治疗寻常型天疱疮(PV)或落叶型天疱疮(PF)成人患者的有效性、安全性和耐受性。研究共纳入了222名PV (n=190)或PF (n=32)成年患者,按2:1的比例随机接受efgartigimod SC和安慰剂治疗。主要终点是在30周内达到CRmin的PV患者比例。次要终点包括达到CRmin的全人群患者比例、累积皮质类固醇剂量、疾病控制和完全缓解的时间。结果显示,研究未达到主要研究终点,efgartigimod SC治疗组达成CRmin的PV患者比例为35.5% (44/124),安慰剂组为30.3% (20/66)。次要终点也都没有达到。efgartigimod SC的安全性和耐受性与其它临床一致。Argenx在新闻稿中提及,efgartigimod SC组患者自身抗体DSG-1、DSG-3降低幅度高达75%,皮质类固醇激素治疗DSG-1和DSG-3下降幅度高达70%。两个治疗组中由皮质类固醇引起的自身抗体减少水平足以使患者达到CRmin。
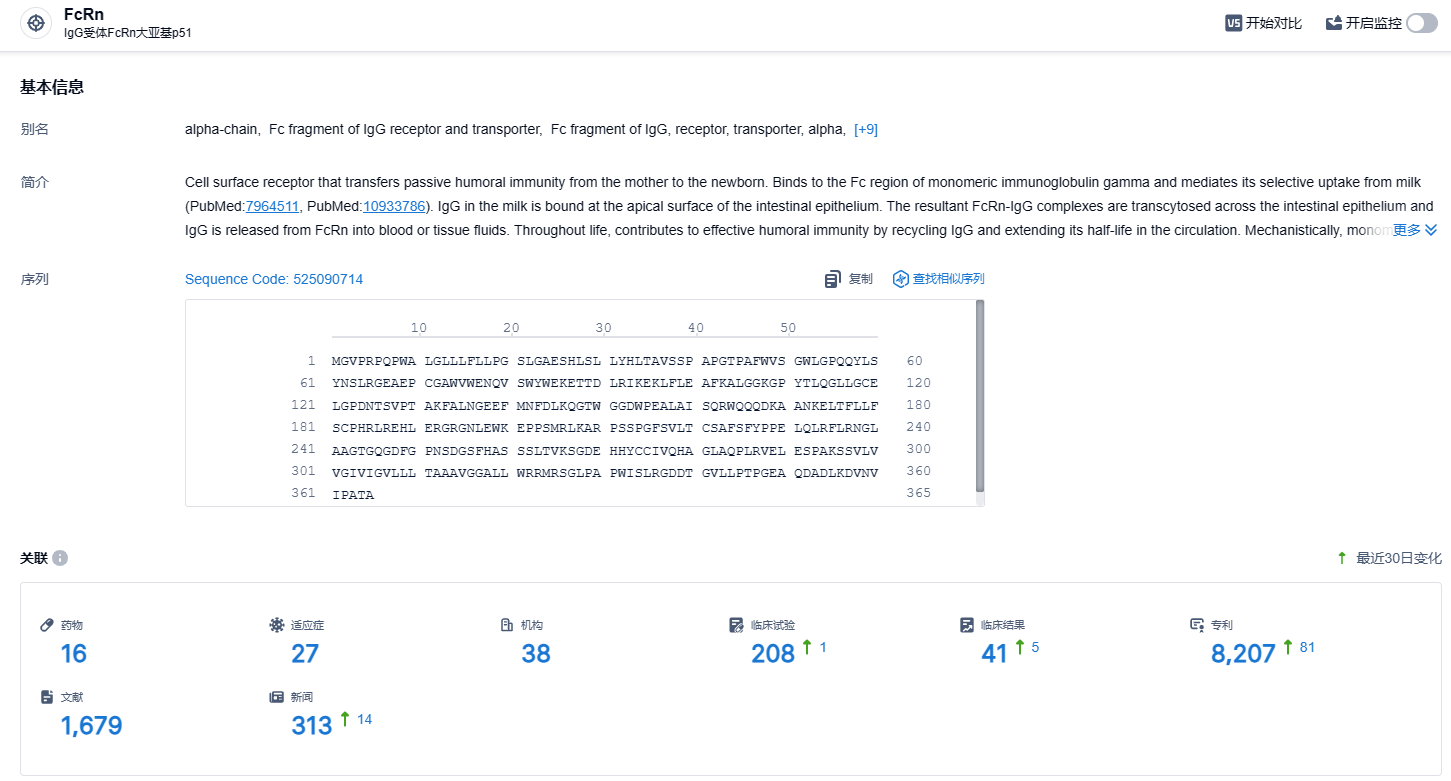
根据智慧芽新药情报库所披露的信息 (点击下方图片直达FcRn靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年12月22日,FcRn靶点共有在研药物16个,包含的适应症有27种,在研机构38家,涉及相关的临床试验208件,专利多达8207件……Argenx正在根据ADDRESS结果以及天疱疮和大疱性类天疱疮之间的可比生物学机制来回顾BALLAD研究,目前不做出是否继续开展的决定。期待艾加莫德其他适应症开发顺利。