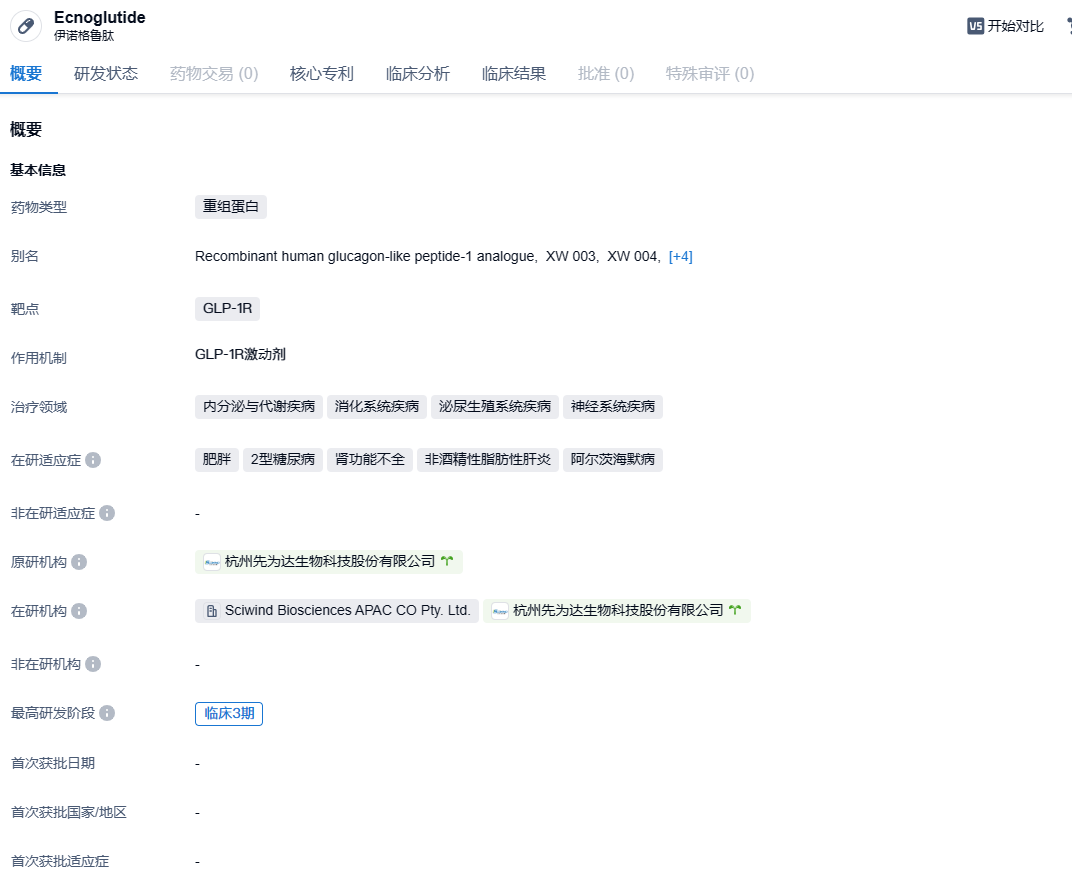
2024年1月24日,先为达宣布口服长效GLP-1R激动剂伊诺格鲁肽片剂1期临床试验已完成的4个试验组取得积极结果。
伊诺格鲁肽(Ecnoglutide,XW003)是由先为达生物研发的一种具有偏向性的新型长效GLP-1R激动剂,经优化后可实现每周给药一次,且在生物活性和生产成本效益方面均有所提高,拟开发治疗2型糖尿病、肥胖症和非酒精性脂肪性肝炎(NASH)。已完成的临床研究证实,Ecnoglutide对2型糖尿病和肥胖症患者具有优良的治疗效果,并显示出良好的安全性和耐受性。2024年1月3日,先为达公布了该公司长效GLP-1R激动剂Ecnoglutide(XW003)治疗中国成人2型糖尿病(T2DM)患者III期临床试验的积极结果。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
这项1期临床试验是一项随机、双盲、安慰剂对照的多次剂量递增研究。口服伊诺格鲁肽的目标剂量在第1-3试验组分别为7mg、15mg或30mg,为期2周;在第4试验组的目标剂量为30mg,为期6周,其中包含剂量递增期。该研究主要评估指标包括口服伊诺格鲁肽的安全性、耐受性、药代动力学和受试者平均体重相对基线的变化。研究显示,口服伊诺格鲁肽的总体安全性和耐受性与肽类GLP-1激动剂的已知安全性特征一致。最常见的不良事件包括恶心、头痛、腹泻、呕吐和食欲减退,大多数不良事件的严重程度为轻中度,主要发生在剂量递增期。
此前公布的III期临床试验(NCT05680155)是一项多中心、随机、双盲、安慰剂对照研究,在中国33家临床试验中心共计招募211名受试者,均为饮食运动干预后血糖控制不佳的成年2型糖尿病患者。受试者随机接受每周一次0.6 mg、1.2 mg Ecnoglutide或安慰剂治疗24周(含剂量递增期),研究的主要疗效终点为治疗24周后糖化血红蛋白(HbA1c)相对基线的改变。受试者在完成24周双盲治疗后进入开放治疗期,继续接受目标剂量0.6 mg或1.2 mg Ecnoglutide的治疗,总治疗期为52周。本研究评估项目包括受试者平均HbA1c、体重、体重指数(BMI)等的变化,以及药物的安全性与耐受性。受试者的基线平均HbA1c为8.5%,平均体重为73公斤。治疗24周后,Ecnoglutide显著降低了受试者HbA1c水平,大多数受试者HbA1c低于7%(美国糖尿病协会推荐的糖尿病患者治疗目标),相当一部分降低至正常水平范围(低于5.7%)。同时,Ecnoglutide组受试者的体重也显著下降。
根据智慧芽新药情报库所披露的信息,截止到 2024 年1月25日,GLP-1R靶点共有在研药物314个,包含的适应症有72种,在研机构277家,涉及相关的临床试验2560件,专利多达7414件……GLP-1受体新药在降糖、减重等领域有着非常大的治疗潜力,期待相关国产新药能够研发顺利。