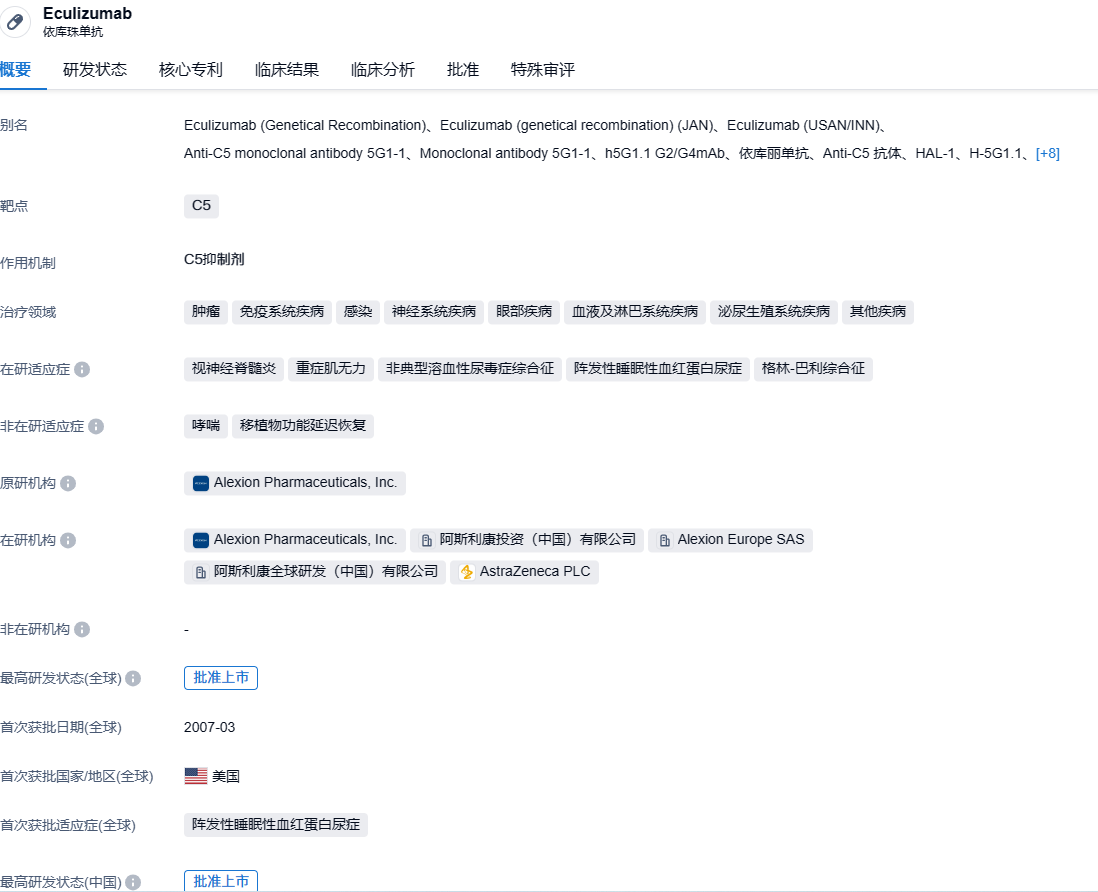
2023年7月27日,阿斯利康发布公告,其开发的抗C5补体药物-依库珠单抗(商品名为Soliris)已经获得欧洲联盟(EU)的正式批准,能够被用作治疗六到十七岁年龄段的带有抗乙酰胆碱受体(AChR)抗体阳性(Ab+)标志的难治性全身性肌无力(gMG)的治疗办法。这是欧洲联盟首个针对儿童重症肌无力患者的靶向治疗办法获得批准。
依库珠单抗是一种人工重组的单克隆抗体,其能够识别并粘合在人体内部的抗原物质上。其作用方式是通过粘附在C5补体蛋白上阻止其功能。C5补体蛋白是人体免疫系统中用来进行补体级联反应的重要组成部分,其活性的增强会引发上述疾病的发生。Soliris(也被称为依库珠单抗)是一种使用于多种疾病的药物,其中包含了阵发性夜间血红蛋白尿症(PNH)、非典型溶血性尿毒症综合症(aHUS)、全身性重症肌无力(gMG)以及视神经脊髓炎谱系障碍(NMOSD)。最初,依库珠单抗是由Alexion公司开发并投放市场的,而在2020年12月12日,阿斯利康以390亿美元的价格收购了Alexion公司,因此也取得了依库珠单抗与另一款抑制剂Ultomiris(Ravulizumab)的所有权。根据阿斯利康的年度报告,依库珠单抗在2022年全球的销售额达到了37.62亿美元。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
此次欧盟委员会的批准是基于人用药品委员会(CHMP)的建议以及针对难治性全身性肌无力病的三期临床试验结果的考证。在这项临床试验中,依库珠单抗展现出了对于免疫抑制治疗失败并且病情未有明显改善的难治性全身性肌无力病儿童患者的治疗效果。在临床试验的26周时,依库珠单抗在定量肌无力(QMG)的总分上显著提高(-5.8 [95% CI -8.4,-3.13],p<0.0004)。依库珠单抗在成熟的难治性全身性肌无力病病人体内的表现和其在六岁以上儿童患者体内的效果及安全性相当。常见的副作用则包含了头痛和鼻咽炎。
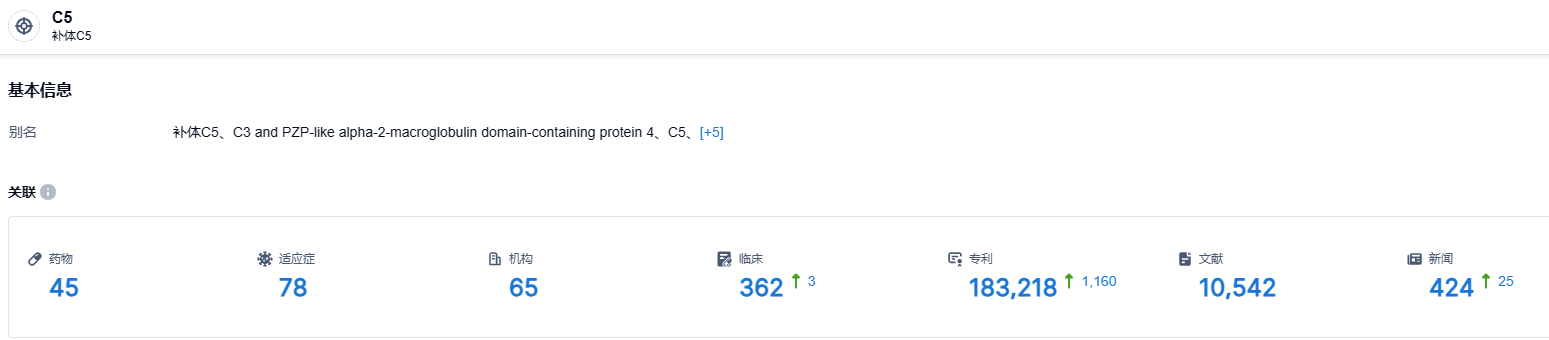
根据智慧芽新药情报库公开的数据, 截止到2023年7月28日,C5靶点有45款在研药物、78种适用疾病、65家参与研发的机构、362个相关的临床试验以及183218项专利等等。