2023年8月3日,TAIHO Oncology与施维雅联合发布消息,宣布组合疗法Lonsurf(trifluridine和tipiracil,中文译名:曲氟尿苷嘧啶)的新的适用场景获得美国食品药物管理局(FDA)的批准。新适用场景是与VEGF抗体贝伐珠单抗联合用于治疗转移性结直肠癌(mCRC)。
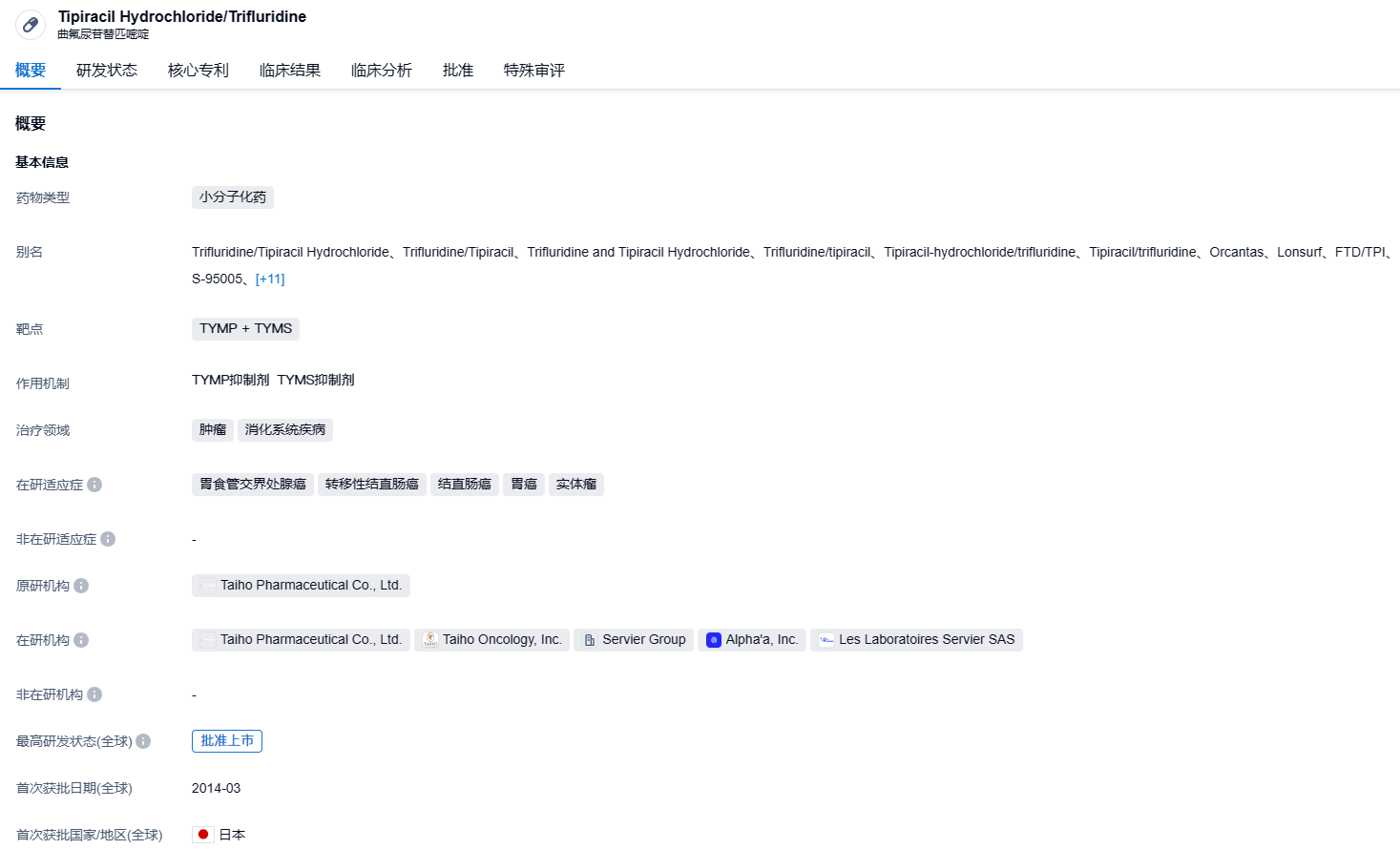
Lonsurf由曲氟尿苷(一种核苷代谢抑制剂)和替吡拉西(胸苷磷酸化酶抑制剂)共同组成,其中替吡拉西能抑制TP对曲氟尿苷的代谢,从而增加曲氟尿苷在体内的暴露,有助于曲氟尿苷进入DNA,并引起DNA功能出错及细胞增长受阻。Lonsurf最初在2014年3月在日本上市,用于治疗无法切除的晚期或复发的结直肠癌。2015年9月,作为转移性结直肠癌单一疗法首次获FDA批准。2019年,中国药监部门批准了该药的原研版本,2021年齐鲁制药获得国内首仿。临床研究显示,Lonsurf与贝伐珠单抗合用的治疗方案与单独使用Lonsurf相比,在总生存期(OS)和无进展生存期(PFS)上都有显著的统计和临床意义上的改善。
 (文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
此次FDA批准是基于一项名为SUNLIGHT的全球多中心、随机、无盲法的III期临床试验。研究结果表明,与单独使用Lonsurf相比,使用Lonsurf与Avastin的联合疗法能显著提高总体生存率,全因死亡风险降低了39%。在Lonsurf-Avastin组中,中位OS为10.8个月(95% CI:9.4,11.8),而在单独使用Lonsurf的组中,中位OS为7.5个月(95% CI:6.3,8.6)。
智慧芽新药情报库公布的最新信息显示,截至2023年8月4日,梗阻性肥厚型心肌病适应症共有在研药物44个,包含的靶点有28种,研发机构有48家,涉及的相关临床试验有1551项,专利多达715项……Lonsurf获得新适应症批准,有可能进一步扩大该药物的商业应用范围,并期待该药的未来表现。