美国食品和药物监督管理局(FDA)驳回了Mesoblast关于间充质干细胞疗法remestemcel-L的上市申请。2023年8月4日,Mesoblast公布了FDA关于此疗法用于治疗激素难以治疗的急性移植反应病症(SR-aGVHD)的儿童患者的生物制品许可申请(BLA)的全面回复。FDA需要该公司提供更多支持申请批准的数据,并且希望在新的临床试验开始之前,解决remestemcel-L在化学、生产和质量控制方面的问题。
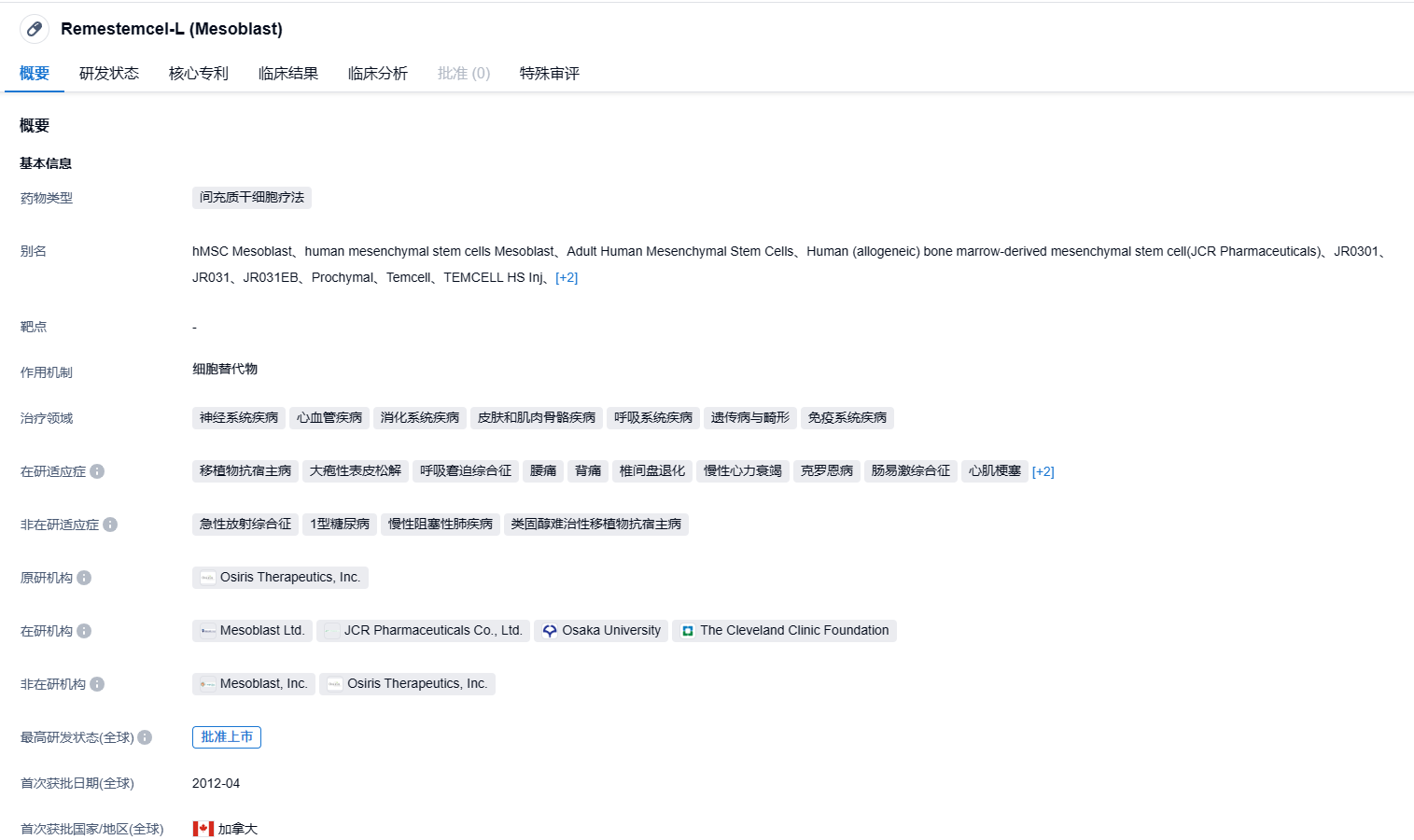
remestemcel-L是由Mesoblast研发的,源自骨髓的同源异体间充质干细胞疗法。该疗法通过静脉注射,用于治疗SR-aGVHD 12岁以下的儿童患者。如果获准上市,remestemcel-L将成为美国首个上市的异体现货细胞药物,也会成为首个针对SR-aGVHD 12岁以下儿童病患的治疗药物。remestemcel-L已经在2015年9月在日本上市,其在日本的开发和商务权益由JCR Pharmaceuticals持有。2020年4月,虽然FDA接受了remestemcel-L的申请,并将其列为优先审查项目,并在2020年8月以9:1的票数获得美国FDA肿瘤药物咨询委员会的强烈支持,但是最后FDA否决了Mesoblast的上市申请,拒绝批准其上市。再次申请上市失败,为remestemcel-L的未来研发投下了阴影。
 (文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
Mesoblast在之前再次提交了更新的临床数据以获取FDA的认可和重新审查申请。这些数据包括:(1)针对高风险儿童群体进行的匹配性研究。对比了25名在Phase III中接受remestemcel-L治疗的儿童和27名接受其他治疗的儿童。研究结果显示,治疗28天内,发布积极反应的高风险儿童为67%,存活期超过180天,而对照组只有10%。(2)51名儿童患者在Phase III中的4年存活数据。结果表明:2年预期存活率从25-38%提高到1年的63%,2年的51%,疗效积极。再次的上市申请失败后,Mesoblast计划针对高风险成人患者的死亡率进行对照实验。
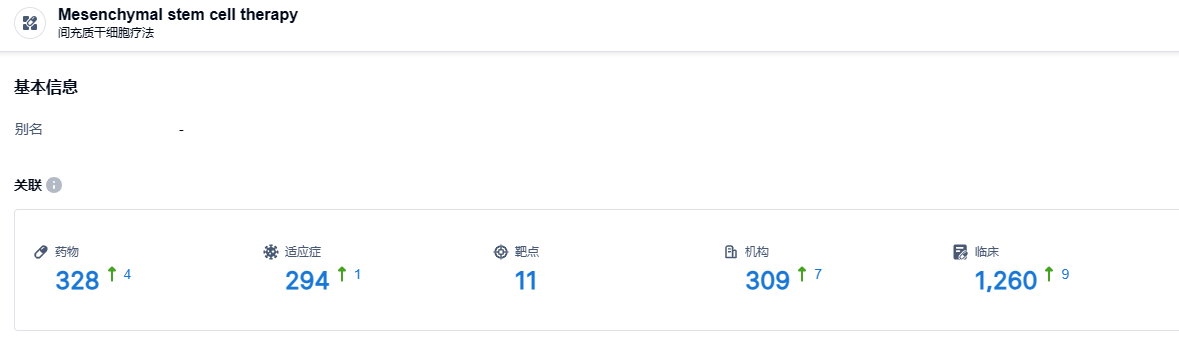
智慧芽新药情报库披露,截止到2023年8月4日,间充质干细胞疗法这一药物类型共有在研药物328个,包含的适应症有294种,靶标11个,研发机构309家,涉及相关的临床试验1260件。间充质干细胞疗法在许多疾病中都表现出了很好的潜力,我们期待remestemcel-L的未来研发能够顺利。