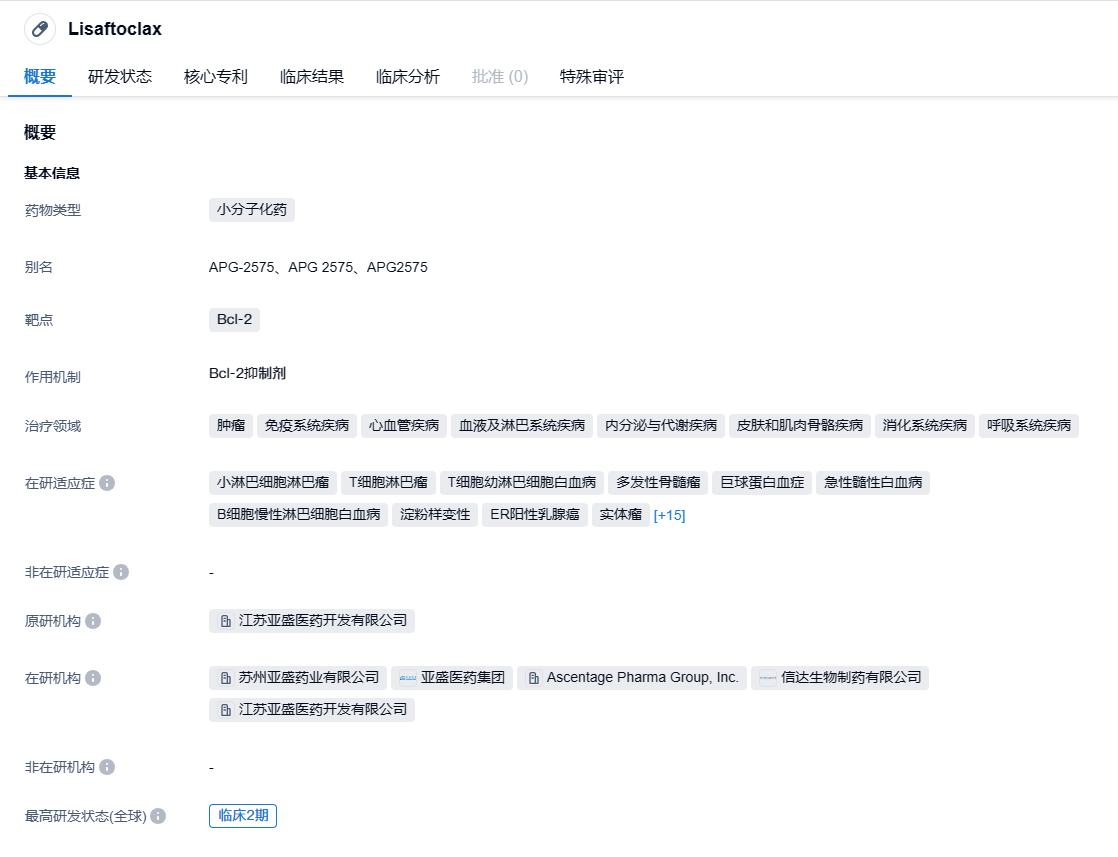
亚盛医药在2023年8月7日宣布了一个重要的消息:美国食品药品监督管理局(FDA)已批准该公司的关键产品,Bcl-2选择性抑制剂 lisaftoclax(亦称APG-2575),对慢性淋巴细胞白血病(CLL)和小淋巴细胞淋巴瘤(SLL)患者进行关键性的全球注册第三阶段的临床研究,这些患者过去已接受其他治疗。
亚盛医药自家研发的新药 APG-2575 是一种口服Bcl-2选择性抑制药物,其作用机理是选择性抑制Bcl-2蛋白,以便恢复癌症细胞的正常死亡过程,实现对肿瘤的治疗。APG-2575有着全球各地最先进的治疗潜力,它是全球第二个,也是中国第一个(又有效且进入关键注册临床阶段的)Bcl-2抑制剂。现在全球已经有19个临床研究正在使用APG-2575,而接受该药物治疗的患者数量已经超过600人,其中包括 300 多名 CLL/SLL 患者。之前的研究表明,APG-2575在CLL/SLL患者中有很高的单一药物和联合治疗效果,是一种更加的效果好和安全的治疗选择。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
这款药现在在美国的试验是一个全球多中心的,随机对照的第三阶段的注册临床试验(名为APG2575CG301)。此项研究的目标是评估APG-2575和布鲁顿酪氨酸激酶抑制剂(即BTKi)一起用于过去接受治疗的CLL/SLL患者的治疗效果和安全性。该研究预计将在 2023 年的下半年开始。该分子药物在全球二期临床试验的初步数据表明,APG-2575和新一代 BTK 抑制剂阿可替尼在CLL/SLL患者中的联合疗效是显著的。
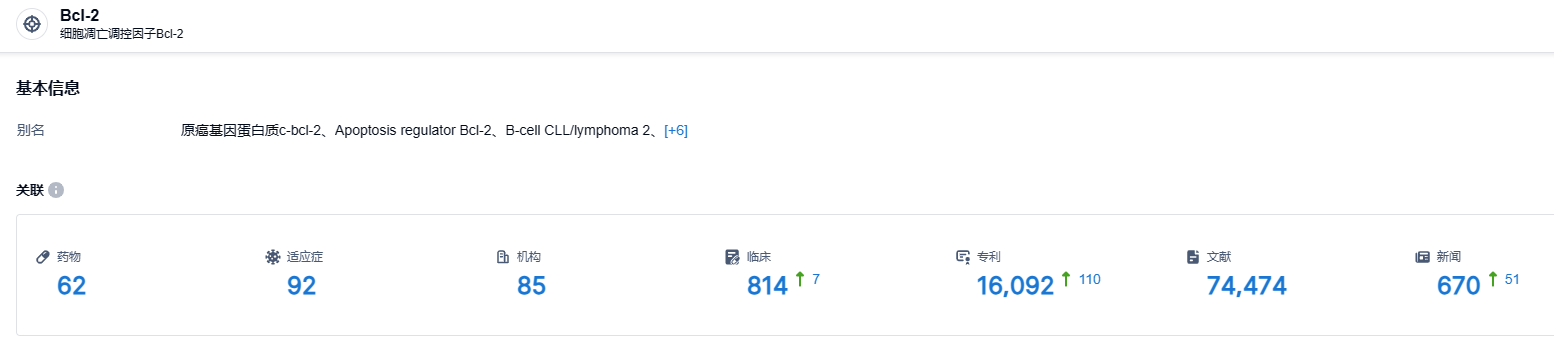
据智慧芽新药情报库发布的信息,截止到 2023 年 8 月 8 日,Bcl-2 靶点共有在研药物 62 个,包含的适应症有 92 种,研究组织达到 85 家,相关临床试验达到 814 个,专利多达 16092 项。希望APG-2575能在美国顺利上市,为患者带来新的治疗方法。