近期,美国疾控中心(CDC)的免疫实践咨询委员会(ACIP)经过10:0的全票通过,强力推荐赛诺菲和阿斯利康联合打造的Beyfortus产品(nirsevimab,也称尼塞韦单抗)作为防止婴儿受到RSV导致的下呼吸道疾病的手段。这为即将到来的或是在第一个RSV高发期内出生的新生儿以及8个月以下的婴儿提供了保护。
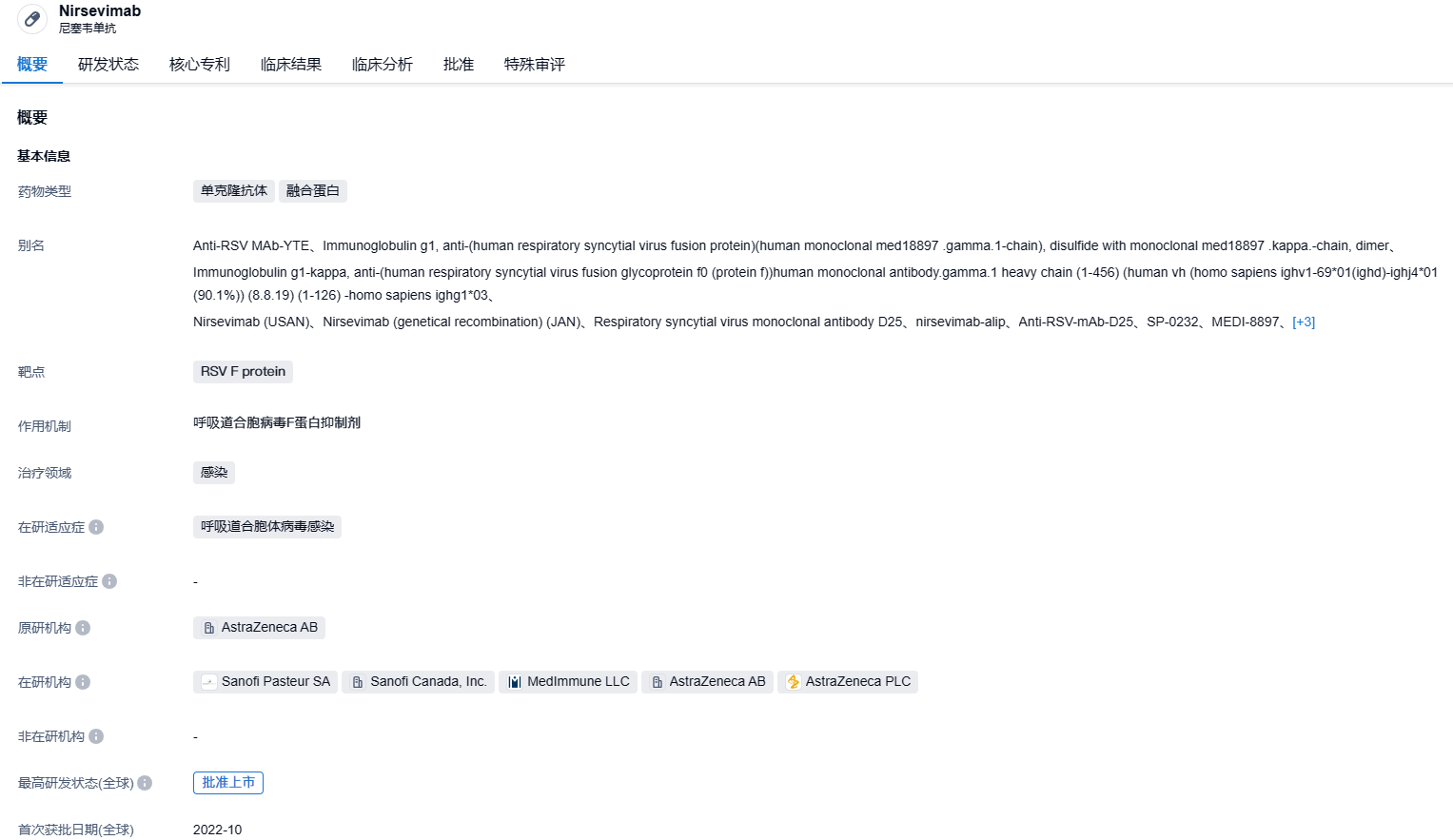
nirsevimab是赛诺菲和阿斯利康联合开发出的一种针对RSV F蛋白前构象的长效重组肌内注射中和人源IgG1ĸ单克隆抗体。它的Fc结构与三个氨基酸替换(YTE突变),以达到延长半衰期的效果。因此,nirsevimab可以在整个RSV高发期保持有效浓度,一次注射便可。2017年,两家公司达成合作协议,阿斯利康负责研发和生产,赛诺菲负责商业化和营收记录。在美国以外的地区,两家公司共同分配了利润和收入,而在美国的商业收益则完全归赛诺菲所有。2022年10月,nirsevimab在欧盟首次通过审核,11月在英国获取批准,2023年2月在日本递交申请,4月在加拿大获得批准。2023年5月,nirsevimab在中国提交申请,得到CDE的优先审查。
 (文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
nirsevimab此番得到FDA批准,基于多项临床试验结果,涵盖了三个关键后期临床试验(2b期、3期MELODY和2/3期MEDLEY)。3期MELODY、2/3期MEDLEY和2b期试验的结果说明,单剂注射nirsevimab能够在婴儿的第一个RSV季节帮助保护婴儿避免RSV疾病的攻击,试验覆盖的人群包括健康的足月儿、健康的晚期早产儿(胎龄≥35周)和早产儿(胎龄29-35周),以及容易感染严重RSV疾病的特殊健康状况婴儿。
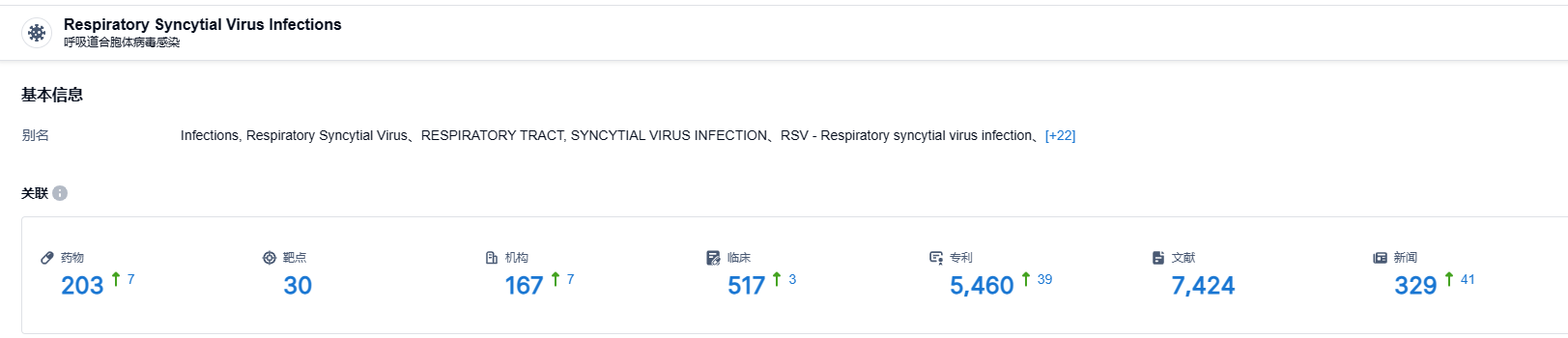
据智慧芽新药情报库公布的信息,截止2023年8月8日,RSV F蛋白靶点共有203种在研药品。适用的疾病种类有30种,研发机构达167家,相关的临床试验有517件,专利数量高达5460个。nirsevimab肯定有很大的市场前景,期待它后续的表现。