艾伯维(AbbVie)已在2023年8月29日向美国FDA和欧洲EMA提交了Skyrizi(Risankizumab)用于治疗中度和重度溃疡性结肠炎(UC)的成人病例的新适应症申请。此次的申请基于INSPIRE和COMMAND两项3期临床试验的结果,其揭示了Risankizumab在促进和维持疗效上的有效性,其中主要临床缓解的终点(根据自适应Mayo评分)和关键次要终点均得以实现。
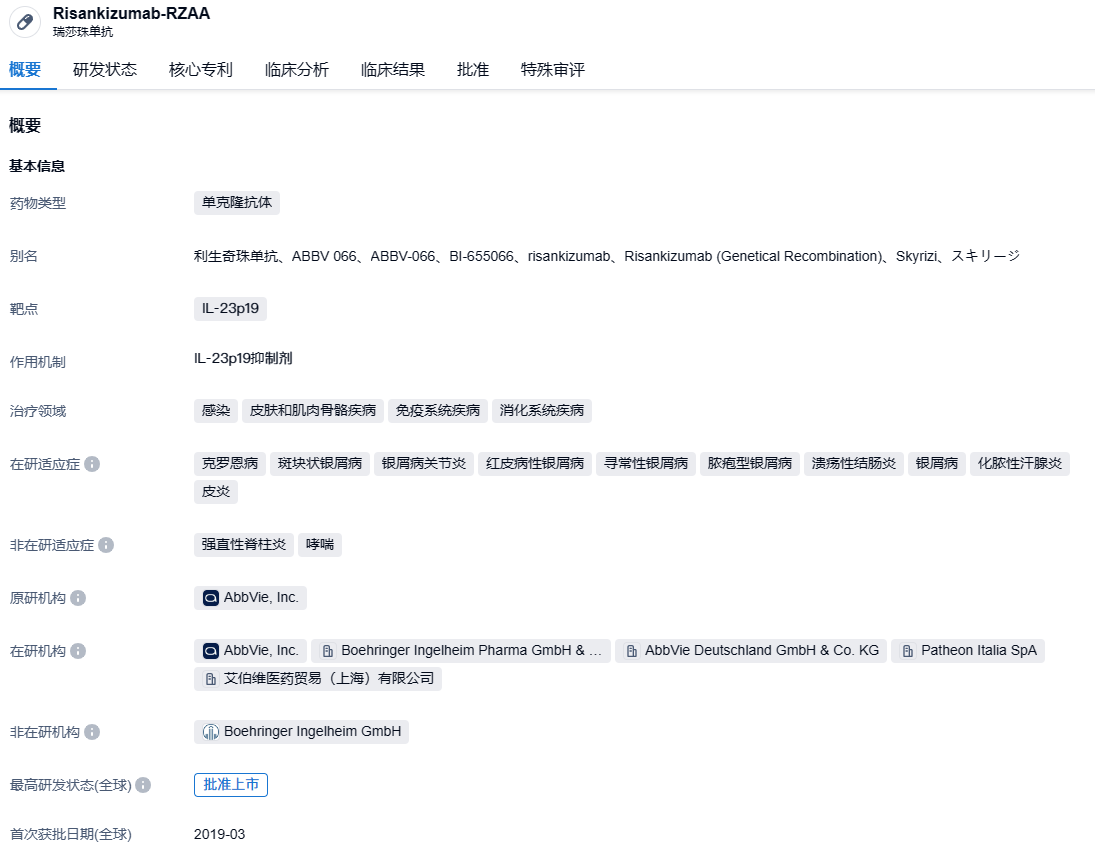
Risankizumab是一种白细胞介素-23(IL-23)的抑制剂,能够与其p19亚基结合起来选择性阻断IL-23。IL-23是一种与炎症过程相关的细胞因子,被认为与多种慢性免疫介导性疾病有关。该药物在2019年4月首次获得批准,目前在FDA和EMA已经批准的适应症包括银屑病性关节炎和斑块型银屑病。自从Skyrizi上市以来,第一年就实现了3.55亿美元的销售额,第二年的销售额达到了15.9亿美元,而在2022年,其全球销售额已上升至51.65亿美元。
 (文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
数据表明,接受180mg和360mg Risankizumab治疗的患者,有着更高的比例在52周内实现了临床缓解,分别为40%和38%,而对照组的该比例则低于25%(p<0.01)。同时,接受180mg和360mg量的Risankizumab治疗的患者中,分别有51%和48%的人在肠镜检查中呈现出改善,而对照组只有32%的患者显示改善(p<0.001)。值得注意的是,接受180mg和360mg Risankizumab治疗的患者中,分别有43%和42%的人在达到组织学内镜检查粘膜改善,这一比例显著高于对照组(23%,p<0.001)。此外,在接受180mg和360mg的Risankizumab治疗的患者中,到达52周时,有一个显著更高的比例达到无皮质类固醇的临床缓解(p<0.01)。
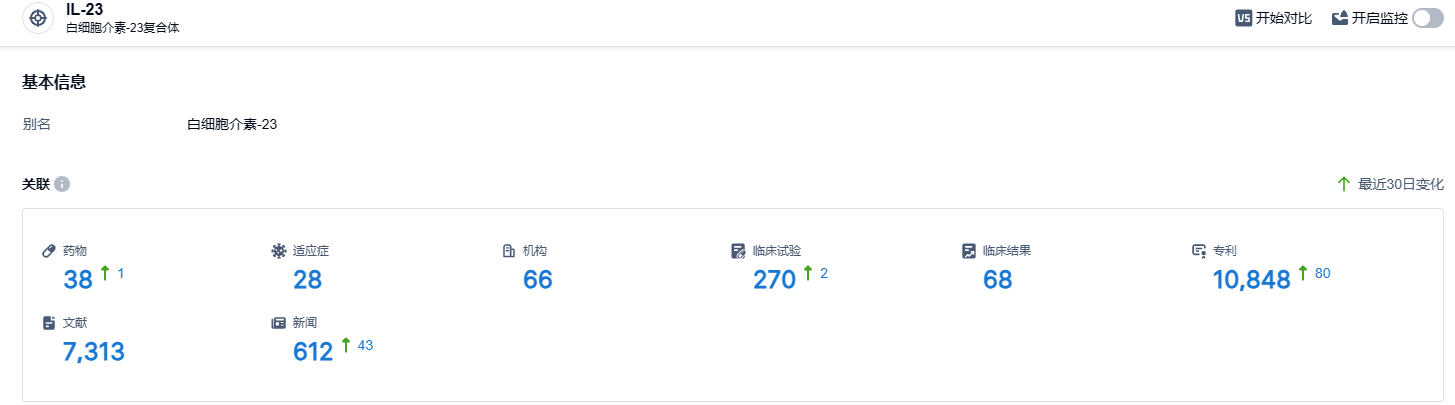
根据智慧芽新药情报库所披露的信息,截至2023年8月30日,已有38种针对IL-23靶点的药物正在研发中,涉及的适用症达到28种,共有66家研发机构参与,此外还有270个相关临床试验和高达10848项专利。Risankizumab自2019年上市以来,其销售已一路飙升,但在全球三大药物市场中,该药物尚未在中国获得批准。相信它在未来进入中国市场后,会取得新的销售纪录。