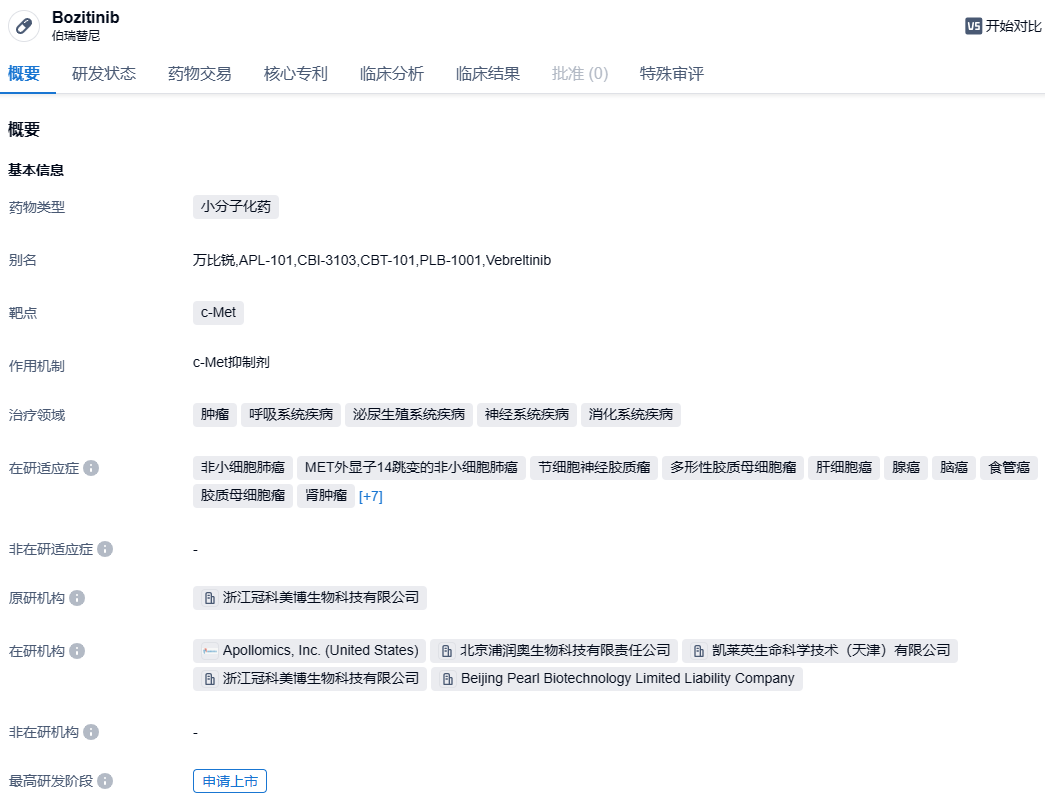
2023年10月24日,中国国家药品监督管理局药品审评中心(CDE)在官方网站公示,鞍石生物旗下全资子公司浦润奥生物申报了1类新药伯瑞替尼肠溶胶囊的新适应症上市申请。此药品计划用于治疗经过放疗和替莫唑胺治疗后复发或不可耐受的,持有PTPRZ1-MET融合基因的IDH突变型WHO 4级星形细胞瘤或在过去有较低级别病史的胶质母细胞瘤(GBM)成人患者。
伯瑞替尼(Vebreltinib)是一个小分子选择性MET抑制剂,在许多临床前MET异常的人类胃癌、肝癌、胰腺癌和肺癌细胞移植动物模型(CDX)和人源肿瘤移植小鼠模型(PDX)中表现出强烈的抑制肿瘤作用。目前,这种药物已在国内注册了7项临床试验,适应症包括NSCLC(非小细胞肺癌)、神经胶质瘤等。2021年2月,伯瑞替尼被CDE纳入突破性治疗品种,用于治疗MET外显子14跳变的NSCLC。2022年9月14日,伯瑞替尼被CDE纳入优先审查。2022年9月24日,“伯瑞替尼肠溶胶囊”1类新药注册申请正式获CDE受理。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
在2023 ESMO年会上,鞍石生物旗下全资子公司浦润奥生物研发的伯瑞替尼(Vebreltinib, bozitinib, PLB1001)Ⅱ期临床试验治疗间质表皮转化因子(MET)外显子14(METex14)跳跃突变的研究结果以壁报的形式展示。这是继2020年在美国癌症研究学会(AACR)公开伯瑞替尼Ⅰ期研究结果之后,鞍石生物再次公布最新的研究成果。
截至2022年8月9日,该研究共纳入113名患者,包括52名有METex14跳跃突变的晚期非小细胞肺癌患者。其中,32.7%(17/52)的患者曾接受过晚期或转移性NSCLC的系统性治疗。主要终点盲法独立阅片委员会(BIRC)评估的客观缓解率(ORR)为75% (95% CI: 61.1%~86.0%),其中的初次接受治疗的患者ORR为77.1% (95% CI: 59.9%~89.6%),已治疗过的患者ORR为70.6% (95% CI: 44.0%~89.7%);疾病控制率(DCR)达到96.2%,中位缓解持续时间(DoR)达到15.9个月,中位至缓解时间(TTR)为1.0个月,中位无进展生存期(PFS)为14.1个月,中位总生存期(OS)为20.7个月。肺癌脑转移患者、肝转移以及年龄≥75岁的高龄患者群体,他们在接受伯瑞替尼治疗后均可获得效益, ORR分别达到100.0%、66.7%、85.7%。
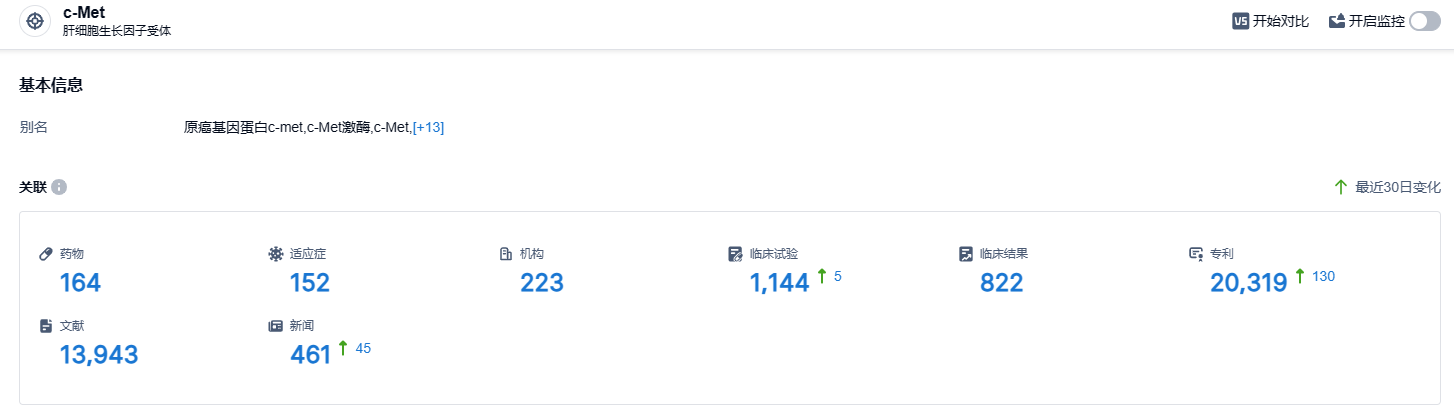
根据智慧芽新药情报库所披露的信息,截至2023年10月26日,有关MET靶点的在研药物有164个,适应症为152种,研发机构有223家,相关的临床试验有1144项,专利数量高达20319项。对于复发的胶质母细胞瘤患者,目前缺乏标准治疗方法,特别是ZM融合基因阳性胶质母细胞瘤患者在标准治疗失败后的情况。期待MET抑制剂伯瑞替尼肠溶胶囊为这个治疗领域提供新方案。