2023年11月13日,华东医药披露了一项消息,其全资子公司杭州中美华东已经成功的从美国Kiniksa公司引入注射用利纳西普(ARCALYST®, Rilonacept),并且,该药品的上市申请已经获得国家药品监督管理局(NMPA)的正式批准,这种药物主要是用于治疗成年人以及12岁以上儿童的冷吡啉相关的周期性综合征(CAPS),包括家族性寒冷型自身炎症综合征(FCAS)和穆-韦二氏综合征(MWS)。
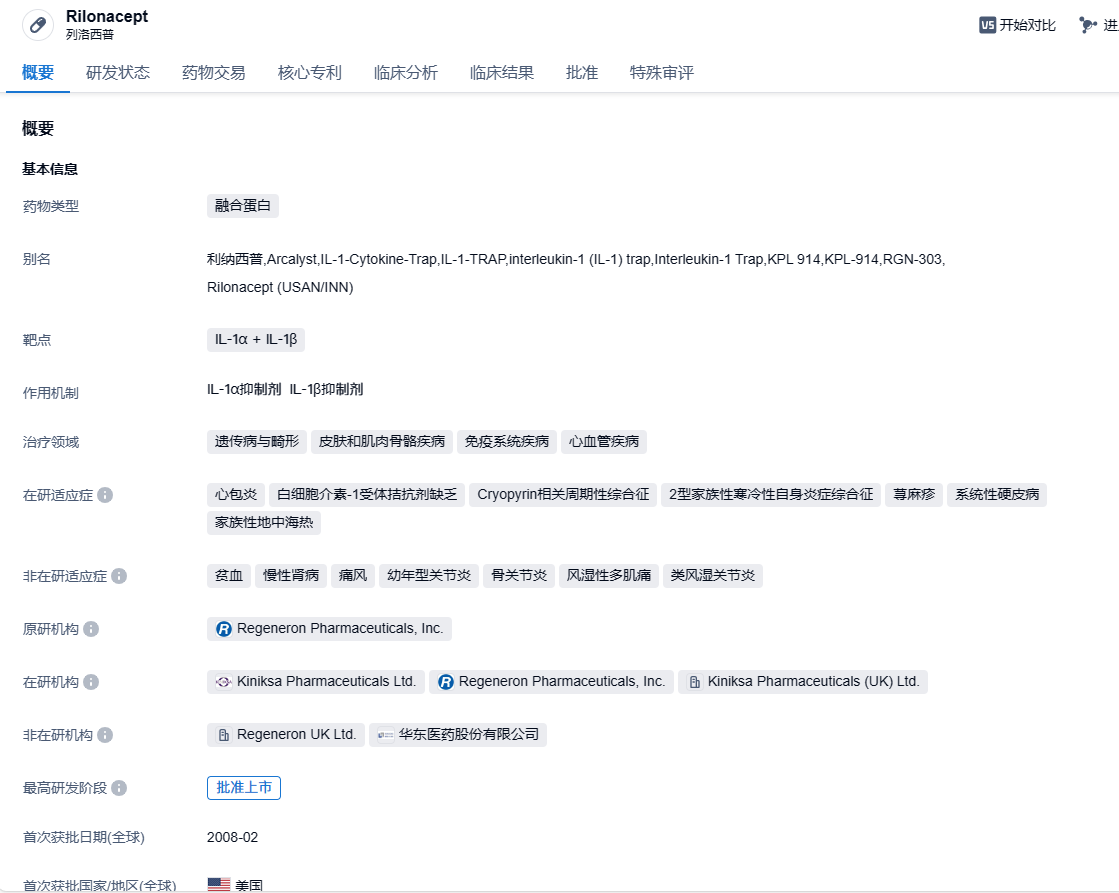
注射用利纳西普(ARCALYST®, Rilonacept for Injection)是中美华东以及美国的Kiniksa Pharmaceuticals公司共同开发的产品,其中美华东在中国、韩国、澳大利亚、新西兰和印度等24个亚太国家和地区(不包含日本)拥有该产品的独家许可,包括开发、注册和商业化权益。
该药物能够有效阻断IL-1α + IL-1β的信号传导,此技术是由Regeneron公司最初研发的,并于2008年获得了美国FDA的批准,用途也主要集中在治疗冷吡啉相关的周期性综合征(CAPS),包括家族性寒冷型自身炎症综合征(FCAS)和穆-韦二氏综合征(MWS)。然后2020年,FDA又批准了它用于治疗IL-1受体拮抗剂缺乏症(DIRA)。2017年,Kiniksa从Regeneron获得了注射用利纳西普的许可。Kiniksa开发该产品用于治疗复发性心包炎(RP),这是一种自身炎症性的心血管疾病,主要症状表现为胸痛。在Kiniksa的开发下,注射用利纳西普于2019年获得FDA突破性疗法认定,用于治疗复发性心包炎。同年,该药物也获得了FDA授予用于治疗心包炎的孤儿药认定。此外,欧盟委员会授予注射用利纳西普用于治疗特发性心包炎的孤儿药认定。到了2021年3月,FDA正式批准了注射用利纳西普用于治疗复发性心包炎,此药也成为了至今FDA唯一批准的适用于12岁以上人群的复发性心包炎治疗药物。Kiniksa的数据显示,2023年1月至9月,注射用利纳西普的收入已经达到了1.62亿美元。
 (文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
由于冷吡啉相关的周期性综合征在我国算是罕见病,且其病情逐渐严重,目前在国内还没有真正有效的治疗手段。所以在2018年,注射用利纳西普被纳入了国家药品监督管理局药品审评中心(CDE)发布的《临床急需境外新药名单(第一批)》。2023年1月,注射用利纳西普被CDE纳入优先审评品种名单。2023年9月,国家卫健委等部门联合发布的《第二批罕见病目录》收录复发性心包炎(RP)。
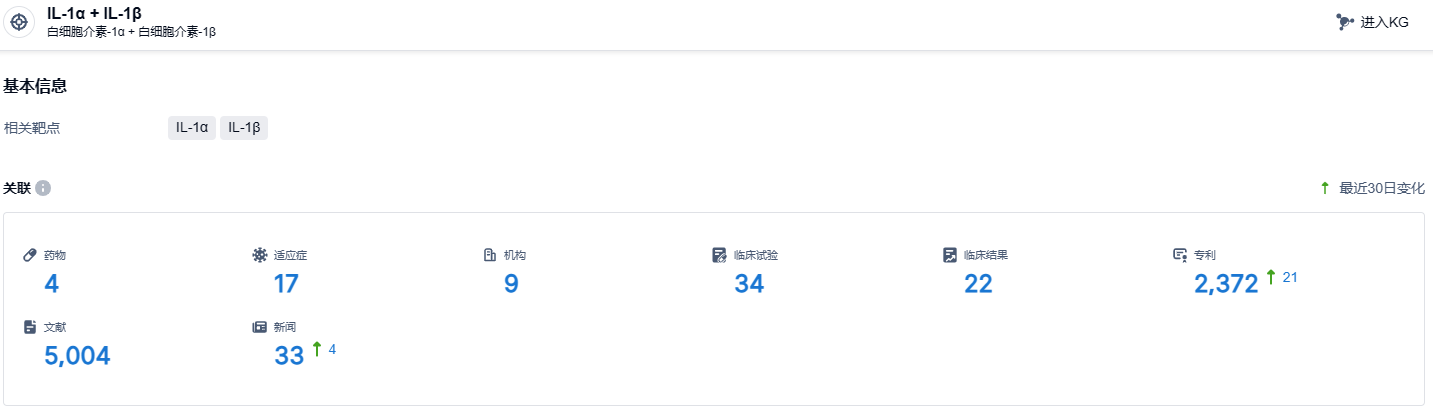
根据智慧芽新药情报库所披露的信息, 截止到 2023 年11月14日,IL-1α + IL-1β靶点的研发药物有4个,包含的适应症有17种,在研机构9家,涉及相关的临床试验34件,专利多达2372件……据Kiniksa预计,利纳西普今年全年有望实现销售收入2.2-2.3亿美元,以中值计算相比2022年增长幅度将达到84%,期待利纳西普早日在国内上市。