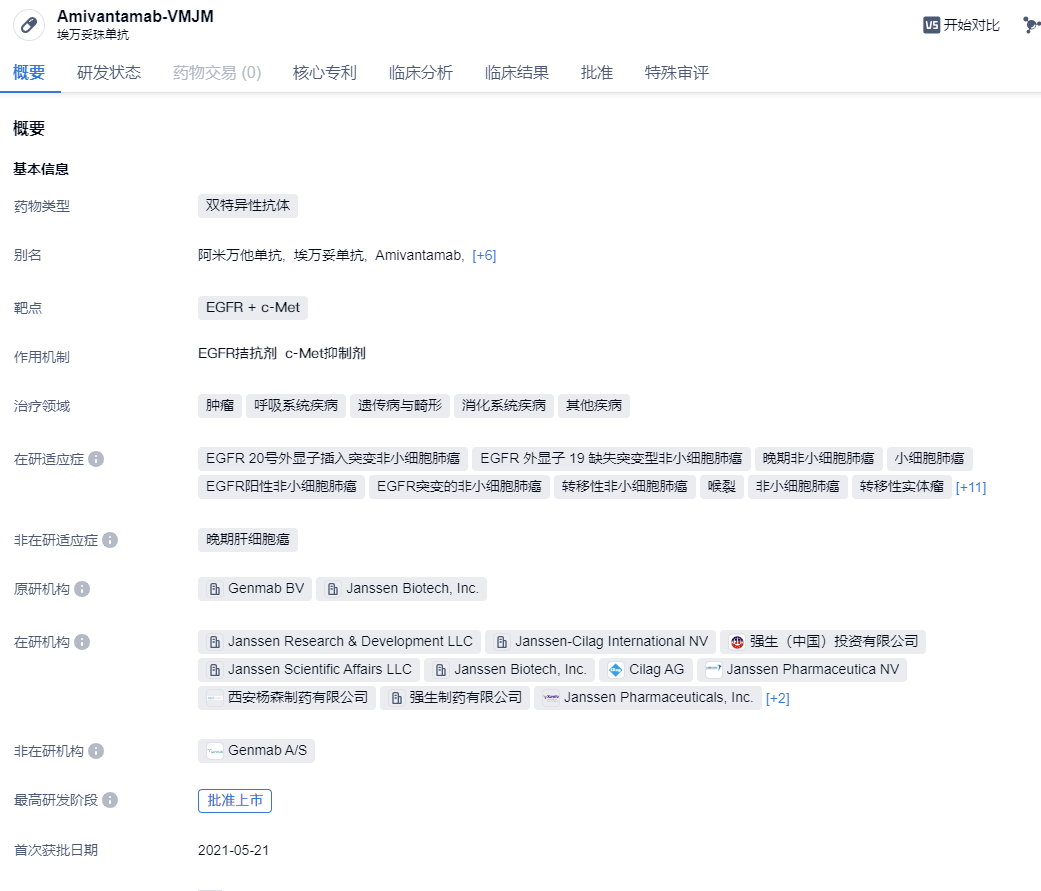
2024年1月26日,中国国家药监局药品审评中心(CDE)官网公示,强生(Johnson & Johnson)旗下EGFR/MET双特异性抗体疗法埃万妥单抗注射液(amivantamab)上市申请获得受理。本次是该产品在中国递交的第三项上市申请。
埃万妥单抗(amivantamab)是一种人源化EGFR + c-Met双特异性抗体药物。抗癌作用机制复杂,既可以阻断EGFR和MET所介导的信号传导,又能引导免疫细胞靶向携带激活性和抗性EGFR/MET突变和扩增的肿瘤。2021年5月,amivantamab在美国FDA获得了上市批准,主要用以治疗在铂类化疗期间或之后进展的EGFR外显子20插入突变NSCLC患者。2020年3月,美国FDA授予埃万妥单抗突破性疗法认定,用于治疗特定NSCLC患者。2023年8月,该产品还向FDA递交了补充生物制品许可申请(sBLA),与化疗联用一线治疗携带EGFR外显子20插入突变的局部晚期或转移性NSCLC患者。根据中国药物临床试验登记与信息公示平台的信息,目前amivantamab正在进行各项临床试验,包含治疗EGFR突变NSCLC的3期试验、治疗晚期或转移性实体瘤(包含EGFR突变型非小细胞肺癌)患者的2期试验及治疗晚期或转移性结直肠癌的受试者的1b/2期试验等。
(文中的所有图片均已设置链接,可直接点击图片跳转到新药情报库免费查看对应图片最新数据详细信息)
强生于今年 7 月、9 月 6 日、9 月 28 日,陆续宣布Amivantamab 在 III 期 PAPILLON 、 MARIPOSA-2 以及 MARIPOSA 临床试验中达到主要终点。并于近日开展的 2023 ESMO 大会上公布了这 3 项试验数据。PAPILLON 是一项 Amivantamab 联用化疗用于初治 EGFR 外显子 20 插入突变晚期或转移性 NSCLC 的 III 期临床试验。结果显示,Amivantamab+化疗组中位 PFS 为 11.4 个月,显著高于化疗组的 6.7个月(HR=0.40;95% CI,0.30~0.53;P<0.001),此外,联合疗法的缓解率达到 73%,也高于单独化疗组的 47%(P<0.001)。MARIPOSA-2 是一项 Amivantamab(Rybrevant/埃万妥单抗)联合 lazertinib 及化疗治疗奥希替尼耐药后的 NSCLC 患者的 III 期试验,研究达到双重主要终点,这是首个对奥希替尼后线治疗带来具有临床意义 PFS 改善的 III 期研究。结果显示:中位随访 8.7 个月,相较于化疗组,Amivantamab+化疗组和 Amivantamab+Lazertinib +化疗组可分别显著降低 52% 和 56% 的疾病进展或死亡风险,中位 PFS 分别为 6.3 个月 以及 8.3 个月(vs 化疗组 4.2 个月),1 年 PFS 率分别为 22%、37%(vs 化疗组 13%)。MARIPOSA 研究则表明,Amivantamab+Lazertinib 相较于奥希替尼一线治疗 EGFR 突变晚期 NSCLC,PFS 显著更优,显著降低 30% 的疾病进展或死亡风险,无论患者是否伴脑转移均获益;DOR 延长 9 个月,OS 具有获益趋势。
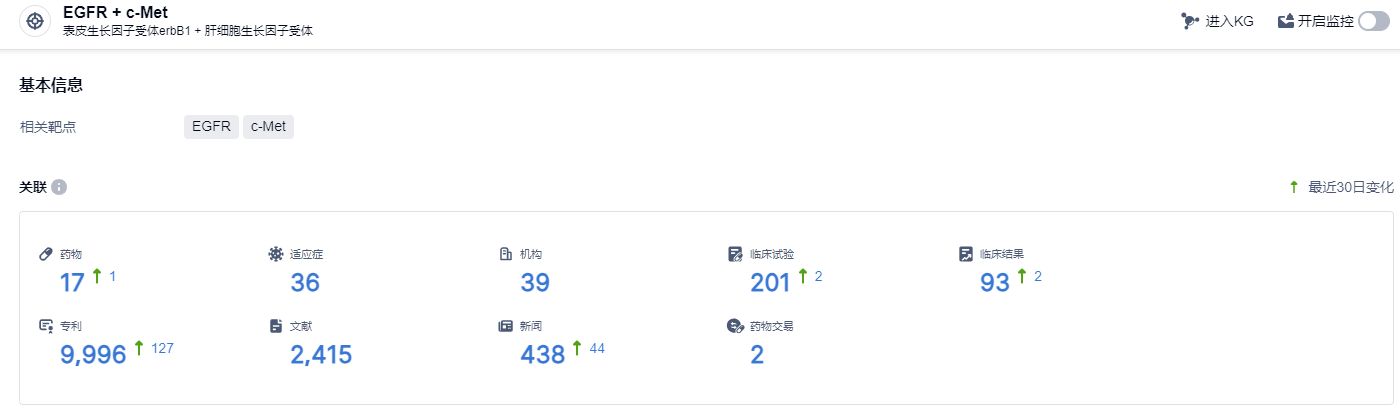
根据智慧芽新药情报库所披露的信息,截止到 2024年1月27日,EGFR + c-Met靶点共有在研药物17个,包含的适应症有36种,在研机构39家,涉及相关的临床试验201件,专利多达9996件……由于Amivantamab优异的数据,预期EGFR/c-Met双抗药物有可能成为EGFR领域下一代的主要产品。在国内,多家公司如岸迈生物、贝达药业、嘉和生物、和翰森制药等都在EGFR/c-Met领域进行布局,期待它们的新药在未来能有好的表现。